
28.(12分)A、B、C、D、E五种短周期元素,其原子序数依次增大。其中,C与E可形成原子个数比分别为1:1和1:2的两种离子化合物;A与E同主族;B与E的原子序数之和等于C与D的原子序数之和。请回答下列问题:
(1)C与E形成的一种化合物可与BC2发生氧化还原反应,该化合物中含有的化学键类型是 ;
(2)由A、B、C、E四种元素组成的一种在日常生活中具有重要用途的酸式盐,溶于水后得到的溶液中存在 种平衡体系,该溶液中各种离子间的电荷守恒关系式为 ;
(3)等物质的量的D单质与E的氢氧化物在一定条件下恰好完全反应,生成一种盐、水和一种气体,该反应的化学方程式 ;
(4)以金属Pt为电极,以E的氢氧化物的溶液作电解质溶液,将A、C的单质分别通入到两个电极上,可以构成原电池。该电池中,在正极上发生反应的物质是 , 负极上的电极反应式为 。
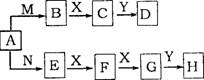 29.(14分)盐A有如图所示的转化关系,已知:X
29.(14分)盐A有如图所示的转化关系,已知:X
是一种气体单质,Y是一种无色液体,一定条件下D和H
的浓溶液都能与金属铜反应。
(1)盐A中阳离子水解的离子方程式 ;
(2)写出E→F的化学方程式 ;
(3)实验室中通常将H的浓溶液保存在 试剂瓶中,且放阴凉处;
(4)苯与D、H浓溶液的混合物共热时发生反应的化学方程式 ;
(5)在一个体积为2L的恒容密闭容器中,充人5mol气体B和3mol气体X,在一定温度下发生反应生成气体C,经5min达到平衡,此时B的转化率为80%。
①在前5min内,用物质C表示的化学反应速率为 ;
②在该温度下,反应的化学平衡常数K= ;
③达到平衡后,若向容器中按物质的量1:1:4的比例再次充人B、X和C,B的转
化率将 (填“增大”、“减小”、“不变”)。
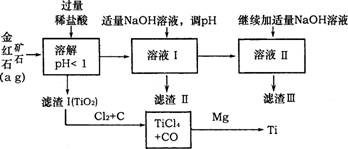 30.(16分)二氧化钛是一种不溶于稀酸的物质,常用于制取金
30.(16分)二氧化钛是一种不溶于稀酸的物质,常用于制取金
属钛。某种金红石矿石的主要成分是TiO2,含有Fe2O3和Al2O3杂质。一研究性学习小组设计如下方案制备金属钛,并得到其它副产品。
(1)已知Fe(OH)3、Al(OH)3,开始沉淀的pH数据(见下表)
|
氢氧化物 |
Fe(OH)3 |
A1(OH)3 |
|
开始沉淀pH |
1.5 |
3.3 |
向溶液I中滴加NaOH溶液,并调溶液pH,若开始只得到一种沉淀,该沉淀是
,应控制pH的范围是 ,反应的离子方程式是 ;
(2)向溶液Ⅱ中“继续加适量NaOH溶液”,若操作不当会减少滤渣Ⅲ的质量,请你设计另一种方案代替向溶液Ⅱ中“继续加适量NaOH溶液”的方案,该方案是 ,反应的离子方程式是 ;
(3)已知:①CO2(g)==C(s)+O2(g); △H =393.5 kJ·mol-l
②CO(g)+ O2(g)==CO2(g); △H =-283 kJ·mol-l
③TiO2(s)+2Cl2(g)==TiCl4(s)+O2(g);△H =141 kJ·mol-l
写出TiO2与Cl2+C反应的热化学方程式 。
(4)若经过多步反应后制得b g金属钛,则金红石矿石中TiO2的质量分数为
[选做部分]
共6个题,考生从中选择2个物理题、1个化学题和1个生物题作答。
15.下列离子方程式错误的是
A.向碳酸氢钙溶液中加入过量氢氧化钠Ca2++ HCO3-+OH-=CaCO3↓+H2O
B.向AgCl浊液中滴加KI溶液AgCl+I-=AgI+Cl-
C.实验室制氯气MnO2+4H++2C1-=Mn2++C12↑+2H2O
D.浓度均为0.1mol·L-1的氢氧化钡溶液与碳酸氢铵溶液等体积混合
Ba2++2OH-+NH4++ HCO3-=BaCO3↓+NH3·H2O+H2O
第Ⅱ卷(必做l20分+选做32分,共152分)
[必做部分]
14.某溶液中含有大量Fe3+、Cu2+和NH4+,其中水电离出的c(H+)=10-1 mol·L-1,在该溶液中一定不能大量存在的阴离子是
A.SO42- B.NO3- C.Cl- D.CO32-
13.下列各项中的两个量,其比值一定为2:1的是
A.1226Mg2+中的中子数和电子数
B.在反应2FeCl3+Fe=3FeCl2中还原产物与氧化产物的质量
C.用惰性电极电解CuCl2溶液时,阴阳两极析出物质的物质的量
D.液面在0刻度时,50mL碱式滴定管与25mL碱式滴定管所盛溶液的体积
12.由实验事实得出的结论,其中正确的是
|
|
实验事实 |
结论 |
|
A |
Cl2的水溶液能导电 |
Cl2是电解质 |
|
B |
SO2通入硝酸钡溶液出现白色沉淀 |
BaSO3不溶于强酸 |
|
C |
金属钠与乙醇反应不如钠与水反应剧烈 |
乙醇分子中的羟基氢原子不如水分子中的氢原子活泼 |
|
D |
加热煮沸滴有石蕊试液的SO2水溶液, 红色褪去 |
SO2具有漂白性 |
11.下列说法正确的是
A.等质量的铝分别与足量稀盐酸、足量烧碱溶液反应时转移的电子数相等
B.36g水与1.204×1024个O2分子在标准状况下所占的体积相等
C.相同温度时,电离常数相同的两种弱电解质在水中的离子浓度相同
D.pH均为2的硫酸和醋酸溶液稀释相同倍数(如100倍)后溶液的pH相同
10.下列实验操作中正确的是
A.配制一定物质的量浓度的硫酸溶液时,用量筒量取一定体积的浓硫酸倒入烧杯后,再用蒸馏水洗涤量筒2-3次,并将洗涤液一并倒入烧杯中稀释
B.玻璃导管蘸水后,边旋转边向橡皮管中插入
C.用胶头滴管向试管中加入液体时,为防止滴在试管外面,应将滴管尖嘴处伸人试管口中
D.称量氢氧化钠固体的质量时,将称量物放在纸片上,并置于托盘天平的左盘,砝码放在托盘天平的右盘
9.在我们日常生活和学习中,常常遇到某些问题涉及化学知识。下列说法不正确的是
A.“墙内开花墙外香”的微观原因是分子的不断运动
B.马铃薯切开后表面很快变为蓝色,这是其中的I-被空气中的氧气氧化为I2,I2
遇淀粉作用造成的
C.医院里检验人是否患有“糖尿病”,就是利用了葡萄糖与氢氧化铜的反应
D.用“糯米酿造米酒”的原理是糯米中的淀粉在酶的作用下发生水解反应
22.A是由C、H或C、H、O元素组成的有机物,取0.1molA在6.72L(标准状况)氧气中燃烧,燃烧后的产物通过足量浓硫酸,浓硫酸增重3.6g,再通过浓硫酸后的气体中点燃Mg条(足 量),生成总质量为26.4g的黑、白两种物质,且黑色生成物与白色生成物的质量比为1∶10。求:
(1)A的分子。
(2)写出属于不同类别两种有机物A的结构简式。
21.CO不仅是家用煤气的主要成分,也是重要的化工原料。美国近年来报导了一种低温低压催化工艺,把某些简单的有机物经“羰化”反应后可以最后产生一类具有优良性能的装饰性高分子涂料、粘合剂等。如下图所示:
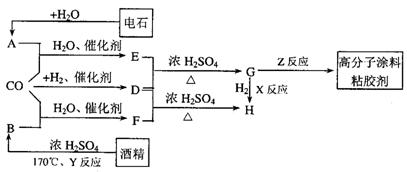
图中G(RCOOR)的一种同分异构体是E的相邻同系物;而H的一种同分异构体则是F的相邻同系物。已知D由CO和H 按物质的理之比为1∶2完全反应而成,其氧化产物可发生银镜反应:H是含有4个碳原子的化合物。试写出:
按物质的理之比为1∶2完全反应而成,其氧化产物可发生银镜反应:H是含有4个碳原子的化合物。试写出:
(1)结构简式:E_____________、G_________________、R’基____________。
(2)G的两个同类别分异构体的结构简式(不带R字母)________________________及__________________________________。
(3)反应类型:X_______________、Y_________________、Z_____________________。
(4)写出下列转化的化学方程式:
 ①A+CO+H
①A+CO+H
 E;②F+D
H。
E;②F+D
H。
①______________________________________________________________。
②______________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com