
7.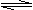 可逆反应aX(g)+bY(g) cZ(g)在一定 温度下的密闭容器内达到平衡后,t0时改变某 一外界条件,化学反应速率(v)一时间(t)图象如下图。下列说法正确的是 ( )
可逆反应aX(g)+bY(g) cZ(g)在一定 温度下的密闭容器内达到平衡后,t0时改变某 一外界条件,化学反应速率(v)一时间(t)图象如下图。下列说法正确的是 ( )
 A.若a+b=c,则t0时只能是增大反应体系的压强
A.若a+b=c,则t0时只能是增大反应体系的压强
B.若a+b=c,则t0时只能是加入催化剂
C.若a+b≠c,则t0时只能是加入催化剂
D.若a+b≠c,则t0时只能是增大反应体系的压强
6.某化学小组用右图所示装置制取氯气,下列说法不正确的是 ( )
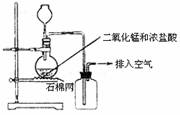
A.该装置图中至少存在三处明显错误
B.该实验中收集氯气的方法不正确
C.为了防止氯气污染空气,必须进行尾气处理
D.在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以证明是否有氯气逸出
5.为降低纯净的碳酸钙与稀盐酸反应制取二氧化碳的化学反应速率,可向溶液中加入( )
A.醋酸钠固体 B.浓盐酸
C.氯化钠固体 D.硫酸钠固体
4.将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗→“出汗” →变 成白色固体(粉末),下列有关叙述不正确的是 ( )
A.表面迅速变暗是因为钠与空气中的氧气反应生成了氧化钠
B.“出汗”是因为生成的氢氧化钠吸收空气中的水蒸气在表面形成了溶液
C.最后变成碳酸钠粉末
D.该过程的所有化学反应均为氧化还原反应
3.下列叙述不正确的是 ( )
A.地球上99%的溴元素以溴单质形式存在于海洋中
B.在每升海水中含量低于1mg的元素称为海水中的微量元素
C.海水是锂元素的一个重要来源
D.世界上生产的镁大部分分来自海水
2.有些科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用。下列关于硅的说法不正确的是 ( )
A.自然界硅元素的贮量丰富
B.自然界中存在大量的单质硅
C.高纯度的单质硅被广泛用于制作计算机芯片
D.硅可由二氧化硅还原制得
1.南极考察队在印度洋发现了一不寻常的鱼,它的血液象水一样无色透明。研究发现这种 鱼的血液中某种元素的含量是其它鱼的血液中的十分之一。这种元素是 ( )
A.Cu B.Ag C.Fe D.Pb
21.(10分)[物质结构与性质]
A、B、C、D分别代表四种不同的短周期元素。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有3个电子。
(1)C原子的电子排布式为 ,若A元素的原子最外层电子排布为1s1,则按原子轨道的重迭方式,A与C形成的化合物中的共价键属于 键。
(2)当n=2时,B的原子结构示意图为 ,B与C形成的晶体属于 晶体。当n=3时,B与C形成的晶体中微粒间的作用力是 。
(3)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,元素
A在周期表中的位置是 ,A、B、C、D四种元素的第一电离能由大到小
的顺序是 (用元素符号表示)。
20.(10分)[有机化学基础]
已知一个碳原子上连有两上羟基时,易发生下列转化:
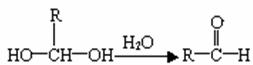
请根据下图回答:
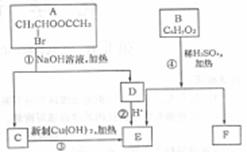
(1)E中含有的官能团的名称是 ;反应③的化学方程式为 。
(2)已知B的相对分子质量为162,其完全燃烧的产物中n(CO2):n(H2O)=2:1,则B
的分子式为 。
(3)F是高分子光阻剂生产中的主要原料。F具有如下特点:①能跟FeCl3溶液发生显
色反应;②能发生如聚反应;③苯不上的一氯代物只有两种。F在一定条件下发生加聚反应
的化学方程式为 。
(4)化合物G是 F的同分异构体,属于芳香族化合物,能发生银镜反应。G有多种结
构,写出其中两种环上取代基个数不同的同分异构体的结构简式
______ 。
19.(15分)A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)常温下,X、Y的水溶液的pH均为5。则两种水溶液中由水电离出的H+浓度之比是 。
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液
与足量的Ba(OH)2溶液反应的离子方程式 。
(3)将铝片和镁片用导线相连,插入由A、D、E三种元素组成物质的稀溶液中构成原
电池,则负极的电极反应式为 。
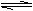 (4)化学反应3A2(g)+C2(g) 2CA3(g)。
(4)化学反应3A2(g)+C2(g) 2CA3(g)。
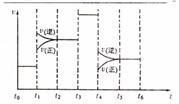 当反应达到平衡时不断
当反应达到平衡时不断
改变条件(不改变A2、C2和CA3的量),右图表示反应速度与反应过程的
关系,其中表示平衡混合物中CA3的含量最高的一段时间是
。温度为T℃时,将4amolA2和2amolC2放入密闭容器中,充分
反应后测得C2的转化率为50%,则反应的平衡常数 。
(5)化合物A8B4D2有如下转化关系:
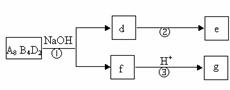
其中,g是常用调味品的主要成分。写出反应①的化学方程式
。
设计实验方案完成d→e的转化
。
[选做部分 10分]
共2个题。考生从中选择1题作答。若两题都做,只批阅20题。只要填写题目中的任意一空,即视为回答该题。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com