
6.下列观点中不正确的是
A.通过化学变化一定能改变物质的性质
B.人们所使用的材料,都是纯度越高越好
C.氧化还原反应中一定会发生电子转移
D.某元素由化合态变为游离态,该元素有可能被氧化,也有可能被还原
5.下列反应不能发生的是
A.木炭投入到热的浓硫酸中
B.木炭投入到热的浓硝酸中
C.铜片投入到冷的浓硫酸中
D.铜片投入到冷的浓硝酸中
4.下列过程没有起到氮的固定作用的是
A.N2与O2反应生成N0
B.N2和H2在一定条件下合成氨
C.NH3经催化氧化生成N0
D.豆科植物的根瘤菌将空气中氮气转化为含氮化合物
3.下列关于浓HNO3与浓H2S04的叙述正确的是
A.都具有吸水性
B.露置于空气中都能形成白雾
C.露置于空气中,溶液浓度均降低
D.在空气中长期露置,溶液质量均减轻
2.下列贮存化学试剂的方法正确的是
A.浓硝酸保存在棕色广口瓶中,并放在阴凉处
B.少量的金属钠应保存在煤油中
C.烧碱溶液放在带玻璃塞的磨口试剂瓶中
D.用做感光材料的溴化银贮存在无色试剂瓶中
1.酸雨给人类带来多种灾害,严重威胁着生态环境。酸雨形成的最主要原因是
A.煤、石油等化石燃料的大量燃烧
B.大气中C02含量的增多
C.森林遭到乱砍滥伐,破坏了生态平衡
D.工业废水的大量排放
32.(8分)[化学-物质结构与性质]
氮及其化合物在生活、生产和科技等方面有重要的应用。请回答下列问题:
(1)氮元素基态原子的价电子排布式为 ;
(2)在氮气分子中,氮原子之间存在着
个 键和----个
键和----个 键;
键;
(3)氮、氧、氟是同周期相邻的三种元素,比较:
①氮原子的第一电离能 (填“大于”、“小于”或“等于”)氧原子的第一电离能;②N2分子中氮氮键的键长 (填“大于”、“小于”或“等于”)F2分子中氟氟键的键长;
(4)氮元素的氢化物--NH3是一种易液化的气体,该气体易液化的原因是
;
(5)配合物[Cu(NH3)4]Cl2中含有4个配位键,若用2个N2H4代替其中的2个NH3,得到的配合物[Cu(NH3)2(N2H4)2]Cl2中含有配位键的个数为 。
31.(8分)[化学-有机化学基础]
下列有机化合物之间有如下的转化关系:
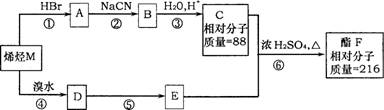
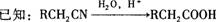
请根据以上框图回答下列问题:
(1)写出反应⑤的化学方程式 ;
(2)写出物质F可能的结构简式 ;
(3)物质E在铜作催化剂条件下被氧化生成G,1 molG与足量银氨溶液反应生成单质银的物质的量为 。
28.(12分)A、B、C、D、E五种短周期元素,其原子序数依次增大。其中,C与E可形成原子个数比分别为1:1和1:2的两种离子化合物;A与E同主族;B与E的原子序数之和等于C与D的原子序数之和。请回答下列问题:
(1)C与E形成的一种化合物可与BC2发生氧化还原反应,该化合物中含有的化学键类型是 ;
(2)由A、B、C、E四种元素组成的一种在日常生活中具有重要用途的酸式盐,溶于水后得到的溶液中存在 种平衡体系,该溶液中各种离子间的电荷守恒关系式为 ;
(3)等物质的量的D单质与E的氢氧化物在一定条件下恰好完全反应,生成一种盐、水和一种气体,该反应的化学方程式 ;
(4)以金属Pt为电极,以E的氢氧化物的溶液作电解质溶液,将A、C的单质分别通入到两个电极上,可以构成原电池。该电池中,在正极上发生反应的物质是 , 负极上的电极反应式为 。
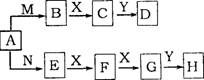 29.(14分)盐A有如图所示的转化关系,已知:X
29.(14分)盐A有如图所示的转化关系,已知:X
是一种气体单质,Y是一种无色液体,一定条件下D和H
的浓溶液都能与金属铜反应。
(1)盐A中阳离子水解的离子方程式 ;
(2)写出E→F的化学方程式 ;
(3)实验室中通常将H的浓溶液保存在 试剂瓶中,且放阴凉处;
(4)苯与D、H浓溶液的混合物共热时发生反应的化学方程式 ;
(5)在一个体积为2L的恒容密闭容器中,充人5mol气体B和3mol气体X,在一定温度下发生反应生成气体C,经5min达到平衡,此时B的转化率为80%。
①在前5min内,用物质C表示的化学反应速率为 ;
②在该温度下,反应的化学平衡常数K= ;
③达到平衡后,若向容器中按物质的量1:1:4的比例再次充人B、X和C,B的转
化率将 (填“增大”、“减小”、“不变”)。
 30.(16分)二氧化钛是一种不溶于稀酸的物质,常用于制取金
30.(16分)二氧化钛是一种不溶于稀酸的物质,常用于制取金
属钛。某种金红石矿石的主要成分是TiO2,含有Fe2O3和Al2O3杂质。一研究性学习小组设计如下方案制备金属钛,并得到其它副产品。
(1)已知Fe(OH)3、Al(OH)3,开始沉淀的pH数据(见下表)
|
氢氧化物 |
Fe(OH)3 |
A1(OH)3 |
|
开始沉淀pH |
1.5 |
3.3 |
向溶液I中滴加NaOH溶液,并调溶液pH,若开始只得到一种沉淀,该沉淀是
,应控制pH的范围是 ,反应的离子方程式是 ;
(2)向溶液Ⅱ中“继续加适量NaOH溶液”,若操作不当会减少滤渣Ⅲ的质量,请你设计另一种方案代替向溶液Ⅱ中“继续加适量NaOH溶液”的方案,该方案是 ,反应的离子方程式是 ;
(3)已知:①CO2(g)==C(s)+O2(g); △H =393.5 kJ·mol-l
②CO(g)+ O2(g)==CO2(g); △H =-283 kJ·mol-l
③TiO2(s)+2Cl2(g)==TiCl4(s)+O2(g);△H =141 kJ·mol-l
写出TiO2与Cl2+C反应的热化学方程式 。
(4)若经过多步反应后制得b g金属钛,则金红石矿石中TiO2的质量分数为
[选做部分]
共6个题,考生从中选择2个物理题、1个化学题和1个生物题作答。
15.下列离子方程式错误的是
A.向碳酸氢钙溶液中加入过量氢氧化钠Ca2++ HCO3-+OH-=CaCO3↓+H2O
B.向AgCl浊液中滴加KI溶液AgCl+I-=AgI+Cl-
C.实验室制氯气MnO2+4H++2C1-=Mn2++C12↑+2H2O
D.浓度均为0.1mol·L-1的氢氧化钡溶液与碳酸氢铵溶液等体积混合
Ba2++2OH-+NH4++ HCO3-=BaCO3↓+NH3·H2O+H2O
第Ⅱ卷(必做l20分+选做32分,共152分)
[必做部分]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com