
5.ClSO2H称为氯磺酸,是一种强酸。对于反应:ClSO2H+HCOOH=CO+HCl+H2SO4有如下
判断,其中较合理的是 ( )
A.此反应属于复分解反应 B.此反应不属于有机物参与的反应
C.反应后溶液的pH值变小 D.反应后溶液的pH值增大
4.某溶液能使紫色石蕊试溶液变红色,经实验测得溶液中存在NO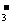 和Ca2+,则该溶液中还
和Ca2+,则该溶液中还
可能大量存在的离子组是 ( )
A.K+、HCO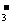 、SO
、SO 、Na+ B.NH
、Na+ B.NH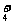 、OH-、AlO
、OH-、AlO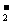 、Cl-
、Cl-
C.Fe3+、CO 、Zn2+、K+ D.NH
、Zn2+、K+ D.NH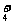 、Cl-、K+、Mg2+
、Cl-、K+、Mg2+
3.设NA为阿伏加德罗常数,下列有关叙述正确的是 ( )
A.1L pH=1的水溶液中水合氢离子数为0.1NA
B.在标准状况下,VL水中含有的氧原子个数为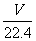 NA
NA
C.1mol癸烷所含共价键数为29NA
D.1molOH-在电解过程中被还原,提供电子的数目为NA
2.下列说法正确的是 ( )
 A.原子晶体中只存在非极性共价键
A.原子晶体中只存在非极性共价键
B.分子晶体的状态变化,只需克服分子间作用力
C.全氟丙烷(C3F2)的电子式为:
D.在CaO和SiO2晶体中,可能存在单个小分子
1.已知NaCN溶液呈碱性;(CN)2与卤素单质的性质相似;CN-的还原性介于Br-、I-之
间。下列反应不能发生的是 ( )
A.CN-+H+=HCN B.(CN)2+C2H4→NC-CH2-CH2-CN
C.(CN)2+2Br-=2CN+Br2 D.(CN)2+2OH-=CN+CNO+H2O
21.(13分)含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料。现有一块已知质量为56.4g的镁铝合金,欲测定其中镁的质量分数,两位同学设计了不同的实验方案。
实验设计I:
镁铝合金 溶液
溶液 过滤,得到沉淀质量为5.8g。
过滤,得到沉淀质量为5.8g。
实验设计Ⅱ:
镁铝合金 测定生成气体在标准状况下的体积为69.44L。
测定生成气体在标准状况下的体积为69.44L。
请回答以下问题:
(1)写出实验设计I中反应②的离子方程式____________。
(2)依据实验设计Ⅱ,求出镁的质量分数。
(3)请你设计第Ⅲ种测定镁的质量分数的方案。
20.(8分)硅是一种重要的半导体材料,广泛应用于计算机技术领域,一些高新技术产品的元件中使用的硅极其纯净,几乎没有任何缺陷。工业上生产半导体材料硅的流程如下:
(1)在制备粗硅时,发生反应的化学方程式为_____________ 。
(2)由四氯化硅得到纯硅的化学方程式是________ 。
(3)实验室中,将细砂粉与镁粉混合加热,也可制得粗硅。这种粗硅往往含有过量的镁、氧化镁和硅化镁(Mg2Si),这些杂质可用盐酸除去。请将此过程中有关反应的化学方程式补充完整: Si02+2Mg Si+2MgO,Mg2Si+4HCI==2MgCl2+SiH4↑
Si+2MgO,Mg2Si+4HCI==2MgCl2+SiH4↑
19.(11分)铁是人类较早使用的金属之一。运用铁的有关知识,回答下列各题:
(1)据有关报道,目前已能冶炼出纯度高达99.9999%的铁,关于纯铁的如下叙述
中,正确的是_____(填序号)。
A.硬度比生铁高
B.耐腐蚀性强,不易生锈
C.不能与盐酸反应
D.与不锈钢成分相同
E.在冷的浓硫酸中钝化
(2)向沸水中逐滴滴加1mol/L FeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒粒度范围是_______nm。
(3)电子工业需用30%的FeCI3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出FeCl3溶液与铜反应的离子方程式 ____,检验反应后的溶液中还存在Fe3+的试剂是____。
(4)欲从腐蚀后的废液中回收铜并重新获得FeCl3溶液,现有下列试剂:
①蒸馏水 ②铁粉③浓硝酸④浓盐酸⑤烧碱⑥浓氨水⑦氯气,
需要用到的一组试剂是________(填序号)。
A.①②④⑦ B.①③④⑥ C.②④⑤ D.①④⑥⑦
18.(8分)煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+702+2H20 4H++2Fe2++___;
4H++2Fe2++___;
②4Fe2++02+4H+ 4Fe3++____;
4Fe3++____;
③FeS2+2Fe3+ 3Fe2++2S;
3Fe2++2S;
④2S+302+2H20 4H++2
4H++2 。
。
已知:FeS2中的硫元素为-l价。
回答下列问题:
(1)根据质量守恒定律和电荷守恒规律,将上述①②离子方程式补充完整。
(2)反应③的还原剂是__________。
(3)观察上述反应,FeS2最终转化为________ 从煤炭中分离出来。
17.(10分)如图在下衬白纸的玻璃片中央放置适量的2KmnO4颗粒,在周围分别滴加一滴KBr溶液,KI淀粉溶液,含有酚酞的澄清石灰水,FeCl2溶液,然后在2KmnO4晶体上滴加适量的浓盐酸,迅速盖好表面皿。
提示:实验室中所用的少量氯气可以用下述原理制取:
2KmnO4+16HCI(浓)==2KCI+2MnCl2+5C12↑+8H20,此反应在常温下即能进行。

(1)a处反应的离子方程式是________。
(2)b处的现象是________;d处的现象是________。
(3)c处反应的化学方程式是________,
工业上用此原理制取漂白粉,在制取过程中用石灰乳而不用饱和石灰水的原因是
__________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com