
15. 在某一容积为2L的密闭容器内,加入0.2mol的CO和0.2mol的H2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+ H2O(g) CO2(g)+H2(g);△H=a kJ/mol。反应达到平衡后,测和c(CO):c(CO2)=3:2。下列说法正确的是( )
在某一容积为2L的密闭容器内,加入0.2mol的CO和0.2mol的H2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+ H2O(g) CO2(g)+H2(g);△H=a kJ/mol。反应达到平衡后,测和c(CO):c(CO2)=3:2。下列说法正确的是( )
A.平衡时H2O的转化率为40%
B.反应放出的热量为0.04akJ
C.判断该反应达到平衡的依据是CO、H2O、CO2、H2的浓度都相等
D.若将容器的体积压缩为1L,有利于该反应平衡正向移动
14.美国加州Miramar海军航空站安装了一台250kW的MCFC型燃料电池,该电池可同时供应电和水蒸气,其工作温度为600℃~700℃,所用燃料为H2,电解质为熔融的K2CO3。该电池的总反应为:2H2+O2 2H2O,负极反应为:H2+CO -2e-=H2O+CO2。则下列推断中,正确的是 ( )
-2e-=H2O+CO2。则下列推断中,正确的是 ( )
A.正极反应为4OH--4e-=2H2O+O2↑
B.当电池生成1mol水时,转移4mol电子
C.放电时CO 向正极移动
向正极移动
D.放电时CO 向负极移动
向负极移动
13.如图a、b两种固体物质的溶解度曲线,下列说法中错误的是 ( )
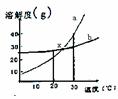 A.a中含有少量b时可以用结晶法提纯a
A.a中含有少量b时可以用结晶法提纯a
B.20℃时a和b饱和溶液的物质的量浓度是a<b
C.30℃时a和b饱和溶液的质量分数是a>b
D.x点表示的a和b溶液都是饱和溶液
12.下列反应的离子方程式不正确的是 ( )
A.在苯酚溶液中加入碳酸钠溶液:C6H5OH+CO →C6H5O-+HCO
→C6H5O-+HCO
B.小苏打溶液和甲酸混合:HCO +H+=CO2↑+H2O
+H+=CO2↑+H2O
C.苯酚钠溶液和甲酸混合:C6H5O-+CH3COOH→C6H5OH+CH3COO-
|
D.用惰性电极电解饱和食盐水:2Cl+2H2O 2OH-+H2↑+Cl2↑
11.下列说法正确的是 ( )
A.加热等物质的量的NaHCO3和Na2O2固体混合物,并在300℃的灼烧至恒重,剩余
|
B.将混有少量CO2的CO通过足量Na2O2,并不断用电火花点燃,则最后CO会消耗完,
且无气体剩余
C.用加热的方法可除去KCl溶液中的Fe3+,证明Fe3+的水解是吸热的
D.将硝酸铵晶体溶于水,若水温下降,则证明硝酸铵水解是吸热的
10.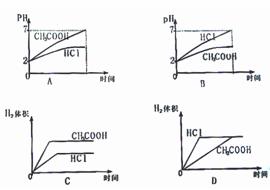 在体积均为1L pH均等于2的盐酸和醋酸溶液中,分别投入0.23g Na,则下图中比较符合反应事实的曲线是 ( )
在体积均为1L pH均等于2的盐酸和醋酸溶液中,分别投入0.23g Na,则下图中比较符合反应事实的曲线是 ( )
9.将1mol H2(g)和2mol I2(g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+I2(g)
 2HI(g);△H<0,并达到平衡,HI的体积分数
2HI(g);△H<0,并达到平衡,HI的体积分数
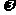 (HI)随时间(t)变化如图(II)所示。若改变
(HI)随时间(t)变化如图(II)所示。若改变
反应条件, (HI)的变化曲线如图(I)所示,
(HI)的变化曲线如图(I)所示,
则改变的条件可能是 ( )
A.恒温恒容条件下,加入适当催化剂 B.恒温条件下,缩小反应容器体积
C.恒温条件下,扩大反应容器体积 D.恒容条件下升高温度
8.对于浓度为c mol/L的NaH2PO4溶液,下列选项正确的是 ( )
A.c (Na+)=c(H3PO4)+
c (H2PO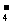 )+ c (PO
)+ c (PO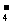 )
)
B.c (H+)+ c (Na+)=c(H32PO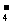 )+ c (HPO
)+ c (HPO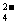 )+ c(OH-)
)+ c(OH-)
C.c (H+)+ c (H3PO4)=c(HPO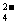 )+2 c (PO
)+2 c (PO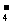 )+ c(OH-)
)+ c(OH-)
D.以上都不对
7.化学实验中,常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是 ( )
A.定性检验SO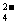 ,将BaCl2溶液用HNO3酸化
,将BaCl2溶液用HNO3酸化
B.为了提高KmnO4溶液的氧化能力,用盐酸将其酸化
C.检验某溶液中是否含Cl-,用HNO3酸化的AgNO3溶液
D.配制FeCl3溶液时通常加少量HNO3酸化、减小其水解程度
6.碳与它非相邻的短周期元素以极性键形成的化合物中,各原子最外层都达到了8电子稳
定结构。满足这种关系的元素共有 ( )
A.3种 B.4种 C.5种 D.6种
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com