
25. (6分)在一定条件下发生反应2SO2(g)+O2(g) 2SO3(g);
(6分)在一定条件下发生反应2SO2(g)+O2(g) 2SO3(g);
(1)500℃时,将a molSO2与b molO2以3:2通入固定容积为5L的密闭容器中。
①反应进行至10min时,测得n(SO2)=8mol,n(SO3)=4mol,则b= mol。
②反应进行至10min时,测得反应放热392kJ,则上述热化学方程式中的
△H= kJ/mol。
③10min内平均速率n(SO2)= mol/(L·min)。
④反应达到平衡后,测得容器内压强是反应起始压强的0.715倍,则平衡时
c(SO3)= mol/L,SO2的转化率a1(SO2)= 。
(2)当反应温度、起始SO2与O2物质的量均与(1)相同时,将其混合气通入一恒压反应容器中,达平衡时SO2的转化率a2与(1)SO2的转化率a2的关系是:a2 a1(填=、>或<)
24.(7分)甲、乙、丙、丁是4种短周期元素,它们的原子序数依次增大,其中甲和丙、乙和丁分别是同主族元素,又知乙、丁两元素的原子核中质子数之和是甲、丙两元素原子核中质子数之和的2倍,甲元素的一种同位素核内无中子。
(1)丙、丁组成的常见化合物,其水溶液呈碱性,原因是(用离子方程式表示)
。写出均含甲、乙、丙、丁四种元素的两种化合物相互间发生反应,且生成气体的离子方程式 。
(2)丁的单质能跟丙的最高价氧化物水化物的浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式 。
(3)甲、乙、丁中某两种元素两丙组合可形成A、B两种微粒,它们均为负一价双原子阴离子,且A有18个电子,B有10个电子,则A与B反应的离子方程式为
。
(4)4.0g丁单质在足量的乙单质中完全燃烧,放出37kJ热量,写出其热化学方程式
。
(5)用甲元素的单质与乙元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,两极均有特制的防止透过的隔膜,在A极通入甲的单质,B极通入乙的单质,则A极是该电池的 极;B极的电极反应式是
。
28.(8分)下列各物质为中学化学中常见物质,其中A、C、E、F为气体,B、D为无色液体,D是一种重要的化工原料,F的浓溶液与X共热通常用于实验室制备单质,C,X是一种黑色粉末,B分子中有18个电子。反应中部分生成物已略去。

试回答下列问题:
(1)B的电子式为 。
(2)写出反应②的化学方程式 。
(3)写出反应①、⑥的离子方程式
① ;⑥ 。
(4)根据图中信息,B、C、D、X氧化性从强到弱的顺序是(用对应物质的化学式表示)
。
22.(8分)(1)已知25℃时几种物质(溶液浓度为0.1mol/L)的电离度如下表:(电离度:弱电解质已电离的分子的物质的量占分子总物质的量的百分数)(已知:H2SO4的第一步电离是完全的)
①H2SO4溶液中的HSO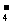 |
②NaHSO4溶液中的HSO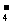 |
③CH3COOH |
④HCl |
|
10% |
29% |
1.33% |
100% |
i25℃时,0.1mol/L上述几种溶液c(H+)由大到小的顺序是(填序号) .
ii25℃时,将足量的Zn粉放入等体积、pH=1的上述几种溶液中,产生氢气的体积(同温同压下)由大到小的顺序是(填序号) .
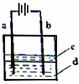 (2)由于Fe(OH)2极易被氧化,所以实验室难以用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所示实验装置,可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
(2)由于Fe(OH)2极易被氧化,所以实验室难以用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所示实验装置,可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
i a电极材料为 ,其电极反应式为 ;
电解过程中,b极附近溶液pH= (增大、减小、不变),
试用必要的文字说明原因 。
ii d电解液是 时,电解片刻后,装置中可见Fe(OH)2白色沉淀。
A.稀硫酸 B.NaCl溶液
C.NaOH溶液 D.CuCl2溶液
iii 装置中液体c的作用是 。
21.(6分)某学生用邻苯甲酸氢钾( 相对分子质量为204.0)测定未知的NaOH溶液的浓度,在本实验中到达滴定终点时,溶液的pH约为9.1。
(1)该学生用托盘天平称量邻苯二甲酸氢钾时(两边均放等质量的纸片),在左盘放一个1g砝码,平衡时游码位置如图所示:

由此可知,所取邻苯二甲酸氢钾的质量为 g.
(2)将称好的邻苯二甲酸氢钾放于锥形瓶中,加适量水溶解,溶液无色,再加入指示剂(从甲基橙、酚酞、石蕊中选择)1~2滴,用NaOH溶液滴定至终点时的现象是
。
(3)该学生进行三次实验,所取固体质量均相同,所需氢氧化钠溶液的体积如下表:
|
实验编号 |
NaOH溶液的体积(mL) |
|
1 |
18.2 |
|
2 |
17.1 |
|
3 |
16.9 |
滴定中误差较大的是第 次实验;造成NaOH溶液体积偏大误差的原因不可能有(填序号) 。
①未用氢氧化钠溶液洗涤滴定管②滴定前平视,滴定后俯视 ③滴定前滴定管尖嘴处有气泡,滴定后气泡消失 ④滴定前,锥形瓶用邻苯二甲酸氢钾溶液润洗
(4)NaOH溶液的物质的量浓度为(只列出计算式,不必求出结果) mol/L。
20.常温下,将m mL NO2和NO混合气通入过量饱和NaHCO3溶液中,再使逸出的气体通过装有Na2O2(过量)的干燥管,最后收集到n mL b气体,据NO2和NO的体积比推断b的成分,正确的是 ( )
A.当V(NO2):V(NO)=3:1时,b为NO2
|
C.当V(NO2):V(NO)>3:1时,b为NO和NO2
D.当V(NO2):V(NO)=3:1时,b为NO2和O2
第II卷(非选择题 共50分)
 三、填空题
三、填空题
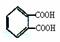
19.某有机物A是浓药生产中的一种中间体,其结构简式如下。下列叙述正确的是( )
 A.有机物A属于芳香烃
A.有机物A属于芳香烃
B.有机物A可以和Br2和CCl4溶液发生加成反应
C.有机物A和浓硫酸混合加热,可以发生消反应
D.1molA和足量的NaOH溶液反应,最多可以消耗3mol NaOH
18.已知烯烃经臭氧化后,在Zn存在下水解可得醛或酮。如:
|
 R1-C=CH-R2
R1-C=O+R2-CHO
R1-C=CH-R2
R1-C=O+R2-CHO
| |
R R
现有化学式为C2H14的烯烃,它与H2加成反应后生成2,3-二甲基戊烷,经臭氧氧化后在Zn存在下水解成乙醛和一种酮,由此可推断该有机物的结构简式为 ( )
A.CH3C=CH-CH-CH3 B.CH3CH=C-CH-CH3
| | | |
CH3 CH3 CH3 CH3
C.CH3CH=C-CH2-CH2-CH3 D.CH3C=C-CH2-CH3
| | |
CH3 CH3 CH3
17.短周期元素X和Y能形成X2YO3离子型化合物,若X的原子序数为m,Y的原子序数为n,则m和n的关系不可能是 ( )
A.m+3=n B.m+5=n C.m+15=n D.n-m=13
16.在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合溶液中加入0.1mol铁粉,充分搅拌后,Fe溶解,溶液中不存在Fe3+离子,同时析出0.1molAg。下列结论错误的是 ( )
A.Fe3+的氧化性大于Cu2+
B.1molFe可还原2molFe3+
C.反应后溶液中Cu2+与Fe2+物质的量比为1:2
D.氧化性:Zn2+>Cu2+>Fe3+>Ag+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com