
25.(6分)
恒温恒容下,将2mol A气体和2mol B气体通人体积为2L的密闭容器中发生如下反应:2A(g)+B(g) xC(g)+2D(s),2min时反应达到平衡状态.此时剩余1.2mol B,并测得C的浓度为1.2mol·L-1。
xC(g)+2D(s),2min时反应达到平衡状态.此时剩余1.2mol B,并测得C的浓度为1.2mol·L-1。
(1)x=_______________;
(2)A的转化率与B的转化率之比为__________________;
(3)保持温度和容积不变,向平衡体系中再充入2mol A和2mol B气体,达到新平衡时B的物质的量为_____________:
(4)欲使反应达到平衡时C的物质的量分数与上述平衡相等,起始加入A、B的物质的量n(A)和n(B)之间应满足的关系为_________________。
24.(8分)
在一定条件下,二氧化硫和氧气发生如下反应: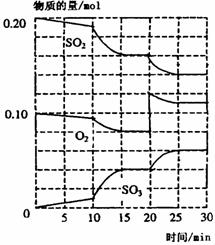 2SO2(g)+O2(g)
2SO2(g)+O2(g) 2SO3(g)△H<O
2SO3(g)△H<O
(1)600℃时,在-2L密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间段是__________;
(2)20-25min,O2的平均反应速率为__________;
(3)10min到15min的曲线变化的原因可能是__________ (填编号);
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
(4)据图判断。反应进行至20min时,曲线发生变化的原因是(用文字表达)__________。
23.(5分)
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
|
t/℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问越:
(1)该反应的化学平衡常数表达式为K=___________;
(2)该反应为____________反应(选填“吸热”“放热”);
(3)能判断该反应是否达到化学平衡状态的依据是下列中的(填序号)__________;
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为______________℃。
22.(5分)
煤燃烧的反应热可通过以下两个途径来利用:I.利用煤在充足的空气中直接燃烧产生的反应热;Ⅱ.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
I.C(s)+O2(g)====CO2(g);△H=E1 ①
Ⅱ.C(s)+H2O(g)====CO(g)+H2(g);△H=E2 ②
H2(g)+ O2(g)====H2O(g);△H=E3 ③
O2(g)====H2O(g);△H=E3 ③
CO(g)+ O2(g)====CO2(g);△H=E4 ④
O2(g)====CO2(g);△H=E4 ④
请填写下列空白:
(1)途径Ⅱ与途径Ⅰ相比有较多的优点,即____________;
(2)上述四个热化学方程式中,反应(填编号)______________.△H>0;
(3)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量正确的关系是(填序号)__________;
A.Ⅰ比Ⅱ多 B.Ⅰ比Ⅱ少 C.Ⅰ与Ⅱ在理论上相同
(4)根据能量守恒定律,E1、E2、E3、E4之间的关系为________________。
21.(4分)
已知下列两个热化学方程式:
H2(g)+ O2(g)====H2O(l)△H=-1285kJ·mol-1
O2(g)====H2O(l)△H=-1285kJ·mol-1
C3H8(g)+5O2(g)====3CO2(g)+4H2O(l)△H=-2220.0kJ·mol-1
(1)实验测得H2和C3 H8的混合气体共5 mol,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3 H8的体积比是_______;
(2)已知:H2O(l)====H2O(g) △H=+44.0kJ·mol-1,写出丙烷燃烧生成CO2和气态水的热化学方程式_________________________________________。
20.右图是温度和压强对反应2Z(g) x+Y的影响示意图,图中横坐标表示温度,纵坐标表示平衡混合气体中z的体积分数。则下列叙述正确的是
x+Y的影响示意图,图中横坐标表示温度,纵坐标表示平衡混合气体中z的体积分数。则下列叙述正确的是
A.上述可逆反应的正反应△H<0
B.X、Y必须均为气态物质
C.若要提高Z的转化率,可向反应体系中加入合适的催化剂
D.若保持恒温恒容的条件,向平衡体系中通入He,容器内压强增大,但正逆反应速率都不变
第Ⅱ卷 (非选择题 共50分)
19.在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应:A(s)+2B(g) C(g)+D(g)已达到平衡状态的是
C(g)+D(g)已达到平衡状态的是
①混合气的压强 ②混合气的密度 ③气体的总物质的量
④混合气的平均分子量 ⑤混合气的总质量 ⑥B的物质的量浓度
A.①②④⑤ B.②④⑤⑥ C.②③⑤⑥ D.①②③④
18.在理论上不能用于设计成原电池的反应是
A.2H2+O2====2H2O(l) △H<0
B.HCl+NaOH====NaCl+2H20 △H<0
C.2CH3OH(l)+3O2(g)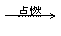
 2CO2(g)+4H2O(l) △H<0
2CO2(g)+4H2O(l) △H<0
D.4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) △H<0
17.吸热反应N2(g)+O2(g) 2NO(g),在2000℃时,K=62×10-4。2000℃时,在10L密闭容器内放入2.94×10-3mol NO、2.50×10-1mol N2和4.00×10-2mol
O2,则下列说法正确的是
2NO(g),在2000℃时,K=62×10-4。2000℃时,在10L密闭容器内放入2.94×10-3mol NO、2.50×10-1mol N2和4.00×10-2mol
O2,则下列说法正确的是
A.此反应的初始状态为化学平衡状态
B.此反应的初始状态为非化学平衡状态,反应将正向进行
C.此反应的初始状态为非化学平衡状态,反应将逆向进行
D.无法判断
16.在一密闭容器中反应mA(g) nB(g)+nC(g)达到平衡。保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,B和C的浓度均是原来的1.8倍。则
nB(g)+nC(g)达到平衡。保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,B和C的浓度均是原来的1.8倍。则
A.平衡向逆反应方向移动 B.物质A的转化率增加
C.物质C的质量分数增加 D.m<2n
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com