
8. 一定温度下,用水稀释c mol·L-1的稀醋酸,若用KW表示水的离子积,则下列数值随水量的增加而增大的是
A.c(CH3COO-)/c(CH3COOH) B.c(CH3CHOOH)/c(H+)
C.c(H+)/c(OH-) D.c(H+)/KW
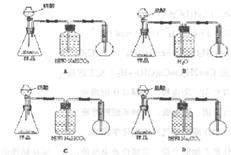
7.现有一工业纯碱样品(含少量氯化钠等不与酸反应的杂质),用下图装置测定样品中碳酸钠的质量分数,其中正确的是
6. 已知正四面体形分子E和直线型分子G反应,生成四面体形分子L和直线型分子M。(组成E分子的元素的原子序数小于10,组成G分子的元素为第三周期的元素)如下图,则下列判断中正确的是

A.上述反应的类型是取代反应 B.E分子中两个键的夹角是90°
C.干燥的G单质有漂白性 D.常温常压下,L是一种液态有机物
5.根据相关化学原理,下列判断正确的是
A.若X的质子数为a,中子数为b,则X的质量数为:a-b
B.若A2+2D-→2A-+D2,则氧化性:D2>A2
C.若R2-和M+的电子层结构相同,则原子序数:R>M
D.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性:NaA<NaB
3.据报道,2006年11月一名俄罗斯前特工在英国因钋中毒而死亡。已知钋单质为银白色金属,在黑暗中能发光,它有两种不同结构的单质 --Po和
--Po和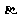 -Po,钋元素有质量数从192到218的全部核素,其常见化合价为+2、+4、+6。下列关于钋的叙述错误的是
-Po,钋元素有质量数从192到218的全部核素,其常见化合价为+2、+4、+6。下列关于钋的叙述错误的是
A.钋元素是放射性元素 B. --Po和
--Po和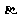 --Po是钋元素的同素异形体
--Po是钋元素的同素异形体
C. 与
与 互为同位素
D.
互为同位素
D. 和
和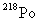 为两种不同的元素
为两种不同的元素
4,下列各组离子一定能大量共存的是
A.在强碱溶液中:Na+、K+、Al02-、C032-
B.在含有大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
C.在c(H+)=10-13mol·L-1的溶液中:NH4+、Al3+、S042-、N03-
D.在pH=1的溶液中:K+、Fe2+、Cl-、N03-
2.有关化学用语正确的是
 A.乙炔的最简式C2H2 B. 蔗糖的化学式C12H22011
A.乙炔的最简式C2H2 B. 蔗糖的化学式C12H22011
C.乙醛的结构简式CH3COH D. 钠离子的结构示意图为
1. 威海的城市建设日新月异,高楼林立,马路宽阔,绿树成荫,鸟语花香。你是否注意到,马路两旁的许多树干上都抹上了白石灰。下列有关说法不正确的是
A. 氢氧化钙显碱性,能使蛋白质变性,所以有防治树木病虫害作用
B.利用白石灰的反光作用,降低晴天吸热,减少昼夜温差,预防树皮冻裂
C.饱和石灰水加入生石灰,若温度不变,则pH不变
D.饱和石灰水加入生石灰,若温度不变,则Ca2+的物质的量不变
28.(7分)
在600K时,反应2NO+O2=2NO2的实验数据如下:
|
初始浓度/(mol·-1) |
初始速率/mol·L-1·S-1 |
|
|
C(NO) |
C(O2) |
|
|
0.010 |
0.010 |
2.5×10-3 |
|
0.010 |
0.020 |
5.0×10-3 |
|
0.030 |
0.020 |
4.5×10-2 |
(1)写出上述反应的速率方程式______________;
(2)经计算.上述反应的反应速率常数为___________;
(3)列式计算,当c(NO)=0.015mol·L-1,c(O2)=0.025mol·L-1时。反应速率是多少?
27.(6分)
请用下图所示仪器装置设计一个包括:电解饱和食盐水并测定电解时产生的氢气的体积和检验氯气的氧化性的实验装置。

(1)所选仪器连接时,各接口的顺序是(填各接口的字母代号):
A接_______、_______接_______;B接_______、_______接________;
(2)实验时.装置中的石墨电极接电源的_____极,所发生的电极反应式为_______________;铁电极的电极反应式为_____________________;此电解总反应方程式为______________。
26.(9分)
如图为相互串联的甲乙两个电解池,X、Y为直流电 源的两个电极。电解过程中,发现石墨电极附近先变红。
源的两个电极。电解过程中,发现石墨电极附近先变红。
请回答:
(1)电源X极为______________极;
(2)甲池若为电解精炼铜的装置,A极是____________极,材料是__________,电极反应为______________;B极是______________极,材料是_______,电极反应为__________,电解质溶液为__________________;
(3)若甲槽阴极增重12.8g,则乙槽阴极放出气体在标准状况下的体积为_________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com