
11.一定能在下列溶液中大量共存的离子组是( )
A.水电离产生的c(H+)=1×10-12mol·L-1溶液:NH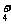 、Na+、Cl-、HCO
、Na+、Cl-、HCO
B.能使pH试纸变深蓝色的溶液中:Na+、[Al(OH)4]-、S2-、CO
C.含有大量Fe3+的溶液:SCN-、I-、K+、Br-
D.澄清透明的无色溶液中:ClO-、MnO 、Al3+、SO
、Al3+、SO
10.设NA表示阿伏加德罗常数的值,下列叙述中正确的是 ( )
A.常温常压下,8.8gCO2和N2O的混合物中所含有的原子数为0.6NA
B.Cu和足量的稀硝酸反应产生4.48L气体时,转移的电子数为0.6NA
C.标准状况下,3.36L丁烷中含有的非极性键数为0.6NA
D.在1L 0.2mol·L-1的硫酸铁溶液中含有的铁离子数为0.6NA
9.下列有关实验的描述正确的是 ( )
A.用湿润的pH试纸测定稀盐酸的pH
B.不能在石英坩埚中熔融氢氧化钠
C.将SO2通入品红溶液或溴水均能使它们褪色,证明SO2有漂白性
D.为了除去乙酸乙酯中混有的少量乙酸,可向其中加入适量的乙醇,加热
25.(8分)金属镁是银白色,但镁带表面呈现灰黑色。用砂纸磨下镁带表面固体粉末,隔绝空气加强热,有水气生成;另取粉末,加入稀酸,产生气体导入澄清石灰水中,产生混浊。
(1)为确定其组成,将镁带表面固体粉末2.84g隔绝空气加强热,产物先用浓硫酸吸收,再用碱石灰吸收,剩余白色固体。浓硫酸增重0.36g,碱石灰增重0.88g,请通过计算确定该组成的化学式。
(2)如果将这种灰黑色的镁条在纯氧中点燃,燃烧产物有黑色物质生成,这种黑色物质的成份是什么?并说明形成的原因。
24.(8分)
 下图中,P为一可自由滑动的活塞。关闭K ,分别向容器A、B中各充入2molX、2molY,起始时,VA=aL:VB=0.8 aL(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)
下图中,P为一可自由滑动的活塞。关闭K ,分别向容器A、B中各充入2molX、2molY,起始时,VA=aL:VB=0.8 aL(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)  2Z(g)+2W(g),达到平衡时,VB=0.6aL。
2Z(g)+2W(g),达到平衡时,VB=0.6aL。
试回答下列问题;
(1)A、B两容器达到平衡的时间:tA ___tB(填“大于”、“小于”或“等于”)
(2)平衡时,B中Y的转化率为_________:反应的平衡常表达式K(B)=_______;当A、B分别达到平衡时,两容器中物质W的百分含量关系是:A ____ B(填“大于”、“小于”或“等于”)。
(3)如果要计算出平衡时B的混合气体的密度,则至少还需要知道的数据是_______ (MX、MY、MZ、MW分别代表X、Y、Z、W的摩尔质量)
①MX ②MY ③MZ ④MWw
A.②和④ B. ①和② C. ①和③ D. ②和③
(4)打开K,一段时间后反应可再次达到平衡,则此时B的体积为________________L。
23.(8分)
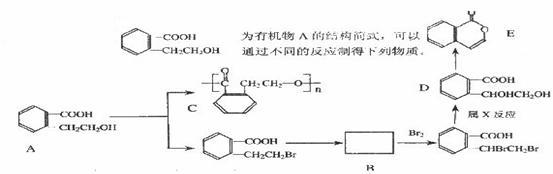
(1)写出A→C的化学方程式:____________________________________________________
(2)推断B物质的结构简式:_________________________________________。X反应类型是___________;由D→E所需的试剂是______________________
(3)R物质属于A的同分异构体,其性质如下:

试写出符合条件的R的同分异构体的结构简式(任写两种):______________________;________________________________。
22.(8分)某研究性学习小组为研究铜与浓硫酸的反应,设计了如右图所示的实验探究方案(装置中的固定仪器和酒精灯均未画出)。

以下是该学习小组部分交流记录及后续探究实验的记录。
实验1:加热后,液面下铜丝变黑,产生气泡,一段时间后液面以上的铜丝也发黑,而且试管上部内壁有少量淡黄色硫固体凝聚,持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。
实验2:截取浓硫酸液面上方变黑的铜丝,插入稀硫酸中无变化,将浓硫酸液面下方变黑的铜丝,插入稀硫酸,黑色明显变浅,溶液呈蓝绿色。
实验3:将浓硫酸液面下方铜丝的黑色物质刮下后,经稀硫酸洗、蒸馏水洗、过滤、干燥后放入氧气流中加热,然后冷却,用电子天平称重发现质量比加热前减少。

[问题探究]
(1)A试管上方的长导管的作用是______;D、E两试管中CCl4的作用是________。
(2)写出淡黄色固体物质消失的化学方程式_________________________________。
(3)试管D中的澄清石灰水变浑浊后又变澄清,变澄清的原因是(用方程式表示)________
(4)根据上述研究,结合资料卡上的内容,你认为液面下方铜丝表面的黑色物质成分肯定有___________________________
21.(3分)下列说法不正确的是______________________________
①称量时,所称量物均放在纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中
②漂白粉、苯酚、水玻璃、烧碱露置在空气中易变质的,应密封保存
⑧不慎将浓碱溶液沾到皮肤上,要立即用大量的水冲洗,然后涂上硼酸溶液
④配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸
⑤给试管里的液体加热时,试管口应略向上倾斜(约45°角),外壁干燥后再预热
⑥使用pH试纸时,将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较
20.(10分)右下图是依各个原子的性质和原子序数(1-20)作的关系图,各图的纵轴可能代表下列的某一个性质:质量数、质子数、中子数、最高正价、原子半径大小、得电子相对能力。而图1-图4所对应的纵轴数值全部是整数,图3中原子序数8、9和图4中原子序数2、10、18在纵轴上没有对应的数值,所以图3中8、9和图4中1和3、9和11、17和19之间以虚线连结。
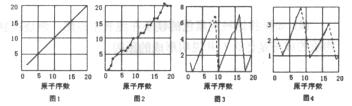
(1)图1一图4的纵轴数值分别代表________、_______、____________、___________。
(2)其中已知aA、bB、cC、dD、eE、gG六种元素原子序数依次增大,原子半径按A、E、D、C、B、G的顺序增大,它们分散在三个短周期中。B是生命体的构架元素,E是同周期中半径最小的元素,G的最高价含氧酸的产量是衡量一个国家化工实力的标志。它们的原子序数存在如下关系:①a+b=c,②(b+d)/2=c,⑨(c+e)/2=d,请根据提供的信息,

回答下列问题:
①右图是元素周期表前三周期的边界,请将A-G六种具体元素符号填在表中相应的位置。
②写出铜与上述某一元素最高价氧化物对应的水化物反应的化学方程式(任写一个)
_______________________________________________________________________
③写出上述元素形成的物质之间能够发生置换反应的化学方程式(任写一个)
________________________________________________________________________
19.(9分)甲醇(CH30H)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。已知CH3OH(l)O2(g)=C0(g)+2H2O(g) △Ha=-443.64KJ·mol-1 2CO(g)+02(g)=2C02(g)
△Hb=-566.0KJ·mol-1
(1)试写出CH30H(l)在氧气中完全燃烧生成C02和H20(汽)的热化学方程式:
_______________________________________________________________________________________________________________
(2)有人认为:在一定条件下,完全可实现由C02和H20(汽)来制取CH30H(l)的反应,从而能缓解能源紧张和温室效应的问题。试通过计算说明,这种反应是否具有可行性?
(3)科研人员新近开发出一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,可使手机连续使用一个月才充一次电,据此回答下列问题:
甲醇在__________极反应;电极反应式为____________________________________________
(4)利用电池可实现电能向化学能转化。某同学设计了一种电解法制取Fe(OH)2的实验装置,通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是_____(填序号)
A. 电源中的a一定为正极,b一定为负极
 B. 可以用NaCl作为电解液
B. 可以用NaCl作为电解液
C. A、B两端都必须用铁作电极
D. 阴极发生的反应是:2H++2e-→H2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com