
6、背景材料:①2006年5月信息时报报道:世界卫生组织建议每天钠的摄取量少于2000毫克,长期过量摄入钠可能引起高血压、肾病、胃病;②2006年诺贝尔化学奖授予美国科学家罗杰-科恩伯格,因为他在分子水平上研究了储存在细胞核基因中的信息如何被复制、转送到细胞的其他地方,用以制造蛋白质,这个过程被称为转录,他首次在真核细胞生物中拍摄到了生命中这个动态过程的真实照片;③2006年初夏,四川大部分地区进行人工降雨;④2005年春末,某高速公路发生液氯运输车翻倒泄露事故。下列相应说法不正确的是( )
A、钠是活泼金属,常常保存在煤油中
B、蛋白质是由氨基酸形成的不可降解的高分子化合物,其水溶液有丁达尔现象
C、AgI和干冰都可用于人工降雨
D、附近人员应迅速远离液氯泄露地点,并逆风往安全区域疏散
32.(8分)[化学-有机化学基础]
有机物A的结构简式为  ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。

请回答下列问题:
(1)指出反应的类型:A→C: 。
(2)在A~E五种物质中,互为同分异构体的是 (填代号)。
(3)写出由A生成B的化学方程式
。
(4)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是 (填序号)。
(5)C能形成高聚物,该高聚物的结构简式为 。
(6)写出D与NaOH溶液共热反应的化学方程式
。
31.(8分)[化学一物质结构与性质]
X、Y、Z三种元素的核电荷数小于18,它们间能形成化合物YX2、ZX2。X原子最外电子层的p能级中有一个轨道填充了2个电子,Y原子的最外层中p能级的电子数等于前一电子层电子总数,且X和Y具有相同的电子层;Z与X在周期表中位于同一主族。回答下列问题:
(1)X的电子排布式为 ;
 (2)Y与Z形成的化合物中的化学键是
键(填“极性”或“非极性”),该分子属于 分子(填“极性”或“非极性”)。
(2)Y与Z形成的化合物中的化学键是
键(填“极性”或“非极性”),该分子属于 分子(填“极性”或“非极性”)。
(3)Y的氢化物中分子构型为正四面体的是 (填名称),中心原子的杂化形式为 。
(4)德国和美国科学家首先制出由20个Y原子组成的空心笼状分子Y20,该笼状结构是由许多正五边形构成(如右图)。请回答:Y20分子共有 个正五边形,共有 条棱边,Y20晶体属于 (填晶体类型)。
30.(16分)某化学研究性学习小组计论Fe3+和SO 之间发生怎样的反应。可能发生的反应有:2Fe3++SO
之间发生怎样的反应。可能发生的反应有:2Fe3++SO +H2O=2Fe2++SO
+H2O=2Fe2++SO +2H+(氧化还原反应)
+2H+(氧化还原反应)
2Fe3++3SO +6H2O=2Fe(OH)3(胶体)+3H2SO4(水解反应)
+6H2O=2Fe(OH)3(胶体)+3H2SO4(水解反应)
为了证明反应的实际情况,同学们设计并实施了下列实验,请填写下列空白:
实验I:学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,实验者设计这个实验的目的是
。
实验II:①取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是 。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是
。将溶液分成两等份,其中一份加入KSCN稀溶液,溶液变成血红色,反应的离子方程式为 。
另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是 。
②换用稀释的FeCl3和Na2CO3溶液重复实验II。实验II、III产生的现象完全相同。由上述实验得出的结论是
。
实验III:若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是 。
从形式上看,Na2CO3和Na2SO3相似。但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
① 。
② 。
[选做部分]
共8个题,学生从中选择2个物理题、1个化学题和1个生物题作答。
29.(10分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:
(注意:其中有些反应的条件及部分生成物被略去)
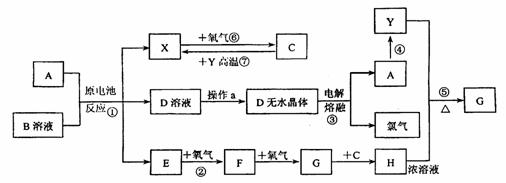 请填写下列空白:
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
。
(2)从D溶液制备D的无水晶体的“操作a”为 。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为 。
(5)原电池反应①中正极的电极反应式为 。
28.(16分)
(I)(1)将0.15mol·L-1稀硫酸V1mL。与0.1 mol·L-1NaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2= 。(溶液体积变化忽略不计)
(2)室温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,据题意,回答下列问题。
①若由0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合而得,则溶液的
pH= 7。
②若溶液pH>7,则c (Na+) c(A-),理由是
。
 ③若由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL。混合而得,则下列说法正确的是
(填选项番号字母)
③若由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL。混合而得,则下列说法正确的是
(填选项番号字母)
A.若反应后溶液呈中性,则c (H+)+ c (OH-)=2×10-7mol·L-1
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定大于V2
 (II)将1.0molI2(g)和2.0molH2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g) 2HI(g);△H<0,并达到平衡。HI的体积分为
(II)将1.0molI2(g)和2.0molH2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g) 2HI(g);△H<0,并达到平衡。HI的体积分为 (HI)随时间的变化如图中曲线(II)所示:
(HI)随时间的变化如图中曲线(II)所示:
(1)达平衡时,I2(g)的物质的量浓度为 。
(2)若改变反应条件,在某条件下 (HI)的变化如曲线(I)所示,则该条件可能是 (填下列条件的序号)。
(HI)的变化如曲线(I)所示,则该条件可能是 (填下列条件的序号)。
①恒容条件下,升高温度 ②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积 ④恒温条件下,扩大反应容器体积
⑤恒温、恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g)、bmolH2(g)和c mol HI(g)(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c应满足的关系为 (用一个含a、b、c的代数式表示)。
15.将甲和乙气体同时通入过量丙溶液中,充分反应后一定产生沉淀的组合是 ( )
|
序号 |
甲 |
乙 |
丙 |
|
① |
CO2 |
SO2 |
Ca(OH)2 |
|
② |
HCl |
CO2 |
Ca(OH)2 |
|
③ |
CO2 |
SO2 |
Ba(NO3)2 |
|
④ |
NO2 |
SO2 |
BaCl2 |
|
⑤ |
CO2 |
NH3 |
CaCl2 |
|
⑥ |
O2 |
NH3 |
AlCl3 |
A.①②⑤ B.①③④⑤⑥ C.①②③④⑥ D.全部
第Ⅱ卷(必做120分+选做32分,共152分)
[必做部分]
14.盖斯定律认为:不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的。
已知:H2O(g)=H2O(l) △H1=-Q1kJ·mol-1
C2H5OH(g)=C2H5OH(l) △H2=-Q2kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3kJ·mol-1
若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量为(KJ) ( )
A.Q1+O2+Q3 B.0.5(Q1+Q2++Q3 )
C.0.5 Q1-1.5O2+0.5Q3 D.1.5 Q1-0.5O2+0.5Q3
13.据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生的化学反应方程式为:5KclO3+6P=3P2O5+5KCl,则下列有关叙述错误的是 ( )
A.上述反应中氧化剂和还原剂的物质的量之比为5:6
B.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中
的水分,生成磷酸小液滴(雾)
C.上述反应中消耗3molP时,转移电子的物质的量为15mol
D.因红磷和白磷互为同分异构体,所以上述火药中的红磷可以用白磷代替
12.X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子数少4,Z的最外层电子数是内层电子总数的3倍。下列有关叙述正确的是( )
A.X肯定为碱金属元素
B.稳定性:Y的氢化物>Z的氢化物
|
D.Y、Z两元素形成的化合物熔点较低
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com