
27.(15分)A、B、C、D、E为中学常见的五种物质,均含元素Y,有的还含有元素X、Z,元素X、Y、Z的原子序数递增。又知①元素在A、B、C、D、E中所呈现化合价递增, 其中只有B为单质;②常温下将气体D通入水中发生反应生成C和E;③工业上以A、空气、水为原料通过催化氧化法制取E。请回答以下问题:
(1)A分子的空间构型是 ;B分子的电子式为 。
(2)写出②中发生的反应的化学方程式 。
(3)由B制取1molA放出46.2KJ的热量,试写出该反应的
热化学方程式: 。
(4)若在1L的密闭容器中加入催化剂和0.8mol 的A,加热并控制一定温度,2min时达到平衡,经测定此时A的物质的量的浓度为0.42mol•L-1 ,则反应开始至达到平衡时,平均速率υ(A)表示的速率为 mol•L-1 •min-1;平衡时容器内气体的物质的量是起始时的______ 倍。
28(15分)为节省药品和时间,甲乙丙三位同学用铜片、锌片。稀硫酸、硫酸铜溶液、直流电源、石墨电极、导线、烧杯、试管等中学化学常见的药品和仪器,进行巧妙的构思,以“接力”的方式。设计了比较铜与锌的金属活动性相对强弱的系列实验。试回答下列问题:
(1)甲同学分别将一小片铜片、锌片置于烧杯底部(铜锌不接触),小心向烧杯中加入稀硫酸,
观到的现象是 。
甲同学的设计思路是 。
(2)乙同学接着甲同学的实验,向烧杯中加 溶液,进而观察到的现象是 。乙同学作出铜锌金属活动性相对强弱的依据是 。
(3)丙同学使用直流电源和石墨电极组装好电极装置,向乙同学实验后的溶液中补充了必要的试剂(作电解液)。反应在调控下随时发生,实验中关电解反应的化学方程式为 ;观察到的明显实验现象是 。
(4)请你再单独设计一个简单的实验(试剂、仪器任选),探究和证实锌和铜金属活动性的相对强弱(简要说明实验操作)_______________。
29(15分)已知烷基苯在酸性高锰酸钾的作用下,侧链被氧化成羧酸。
高分子化合物G是制备饮料瓶的材料,G可通过B和F发生缩聚反应
而制得。现通过如下转化关系合成G:
已知: 其中A是分子式为C8H10的芳香烃,苯环上一溴代物只有一种,B物质呈酸性。取0.46gC蒸汽在足量的氧气中完全燃烧时,需要氧气的体积是C的3倍(同温同压),生成0.88g CO2 和0.54g H2O 。
根据以上信息回答下列问题:
(1)写出A、C的结构简式
A ;C 。
(2)写出下列反应的化学方程式
C→D 。
B+F→G 。
(3)指出下列反应的反应类型
D → E ;E → F
(4)C和F的关系是
A. 同系物 B. 同分异构体 C. 同素异形体 D. 同类物质
13.有一瓶无色气体,可能含有CH4 、CO2 、HCl 、HBr 、SO2 中的一种或几种,将其通入氯水中,得无色透明溶液,将这种溶液分为两份,向一份中加入用盐酸酸化的BaCl2 溶液,出现了白色沉淀;向另一份中加入用硝酸酸化的AgNO3 溶液,也产生了白色沉淀,则有关的气体组成的叙述中,正确的是
A.肯定有HCl 、SO2 B.可能含有HBr 、CO2
C.肯定没有CO2 、CH4 、HBr D.以上结论均不正确
26(15分)图中①-⑩分别代表有关反应中的一种物质,它们均为中学化学中的常见物质.已知①-⑤和⑥-⑩中分别含有同一种元素.反应⑤→①+
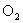 的条件未标出.请填写以下空白:
的条件未标出.请填写以下空白:

(1)化合物⑧中的阳离子是 ;⑤、⑥化学式分别是⑤_ ____;⑥____。
①的晶体类型为 ,⑩→⑥的反应类型为
(2)②、③反应的离子方程式是_______________________________。
(3)⑨→⑩反应的离子方程式是___________________________.
12.取a g某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了a g。下列物质中不能满足
上述结果的是 :
A.H2 B.CO C.C12H22O11 D.HCHO
11.若NA为阿伏加德罗常数,则下列叙述正确的是
A. 标准状况下,12g C60中含有的碳原子数为NA
B. 3.9 g金属钾变为钾离子时,失去的电子数为 NA
C. 标准状况下,22.4 L以任意比例混合的CO2 与CO气体中含有的碳原子数约为2NA
D. 在1 L 1 mol·L-1的盐酸中,所含氢原子数约为NA
10.在强碱溶液中,下列各组离子能够大量共存的是:
A. Mg2+ 、Ca2+ 、HCO3― 、Cl―
B. Na+ 、Al3+ 、ClO― 、SO42―
C. K+ 、Fe2+ 、SO42― 、Br―
D. ClO― 、K+ 、Cl― 、SO42―
9.下列说法正确的是:
A. 金属氧化物都是碱性氧化物
B. 有单质参加或单质生成的化学反应一定是氧化还原反应
C. 构成分子晶体的分子中不一定都存在化学键
D. 由同种元素构成的物质一定属于纯净物
8.等物质的量浓度的下列溶液中, 离子的浓度最大的是:
离子的浓度最大的是:
A. NH4Cl B. NH4HCO3 C. NH4HSO4 D. NH4NO3
7.已知白磷(P4)与CuSO4溶液反应的化学方程式为:P4+CuSO4+H2O→Cu3P+H3PO4+H2SO4,则1molCuSO4能氧化磷原子的物质的量是:
A. 2/5mol B.1/5mol C.11/5mol D.1/10mol
6.下列各组物质的沸点, 前者高于后者的是:
A.干冰、二氧化硅 B.乙醛、甲醛
C.金属汞、金属银 D.足球烯(C60)、单晶硅
29.(12分)A、B、C、D均为中学化学常见的物质,其组成元素均为主族元素。它们间的反应关系如下图所示。[除(2)外,反应均在常温下进行]

(1)若A为金属钠,B为MgCl2溶液,则白色沉淀D为_____________(写化学式)
(2)若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则A与B反应(加热)的化学方程式为__________________________________________________________________________________。
(3)若A是碳化钙(CaC2),B是一种盐,A与B的溶液反应时只生成气体C、CaCO3和水;则B的化学式为__________________________;若C的燃烧热为1300kJ·mol-1,则C燃烧热的热化学方程式为__________________________________________________________。
(4)若B是Al2(SO4)3,D既可溶于盐酸又可溶于NaOH溶液,A的相对分子质量与D相同,推知A的化学式为___________________,向含1molB的溶液中逐渐加入固体粉末A,当A与B以物质的量之比3:2或_________时,生成的D的质量相等。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com