
14.右图为短周期的一部分,推断关于Y、Z、M的说法正确的是
A.非金属性:Y>Z〉M
 B.原子半径:M>Z>Y
B.原子半径:M>Z>Y
C. 气态氢化物的稳定性:Y<M<Z
D. ZM2分子中各原子的最外层电子均满足8e-稳定结构
13.下列对阿佛加德罗常数数值描述最准确的是
A.720g12C60所含的分子个数
B.1mo1 HCI溶于水中H+的个数
C.22.4LN2所含的分子数
D.常温常压下,0.1mol羟基(-OH)所含电子的个数
12.下列叙述正确的是
①生活中用电解食盐水的方法制取消毒液是利用了盐的水解的原理
②乙醇和汽油都是可再生资源;所以应大力全面推广使用乙醇汽油
③建设三峡大坝需要使用大量水泥,水泥足硅酸盐材料
④夏天人们佩戴由添加氧化亚铜的二氧化硅玻璃制作的变色眼镜来保护眼睛
⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能
A.①②③ B.②④ C.③④⑤ D.③⑤
11.下列实验能达到预期目的的是
①用食醋和澄清石灰水验证蛋壳中含有碳酸盐
②将CL2的制备和性质实验联合进行以减少实验中的空气污染
③用硝酸钡溶液鉴别硫酸根离子与亚硫酸根离子
④用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
⑤用溴水既可鉴别乙烷和乙烯,又可除去乙烷中的乙烯
A.①②③ B.①③④ C.①②⑤ D.②④⑤
9.下列说法正确的是
A.宏观上的物质对外不显电性,是因为组成它们的微观粒子都是电中性的原 子和分子
B.某物质经科学测定只含有一种元素;则可以断定该物质是一种纯净物
C.利用化学方法,我们可以制造出新的分子,但不能制造出新原子
D.由两种元素组成的电解质分子中,显正价的是阳离子,显负价的是阴离子
1O.下列叙述正确的是
A.用PH试纸可以直接测出酸或碱的浓度。
B.反应AgCl + NaBr=AgBr+NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水
C.葡萄糖、油脂、聚氯乙烯都属于高分子有机化合物
D.只有反应速率很高的化学反应才能应用于工业生产
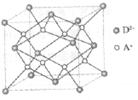
24.(8分)[化学一物质结构与性质]
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的P轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2:1。
请回答下列问题:
(1)A元素形成的晶体属于A2密堆积型式,则其晶体内晶胞类型应属于_______(填写“六方”、“面心立方”或“体心立方”)。
(2)B-的电子排布式为______________,在CB3分子中C元素原子的原子轨道发生的是_________________杂化。
(3)C的氢化物的空间构型为________,其氢化物在同族元素所形成的氢化物中沸点最高的原因是_____________。
 (4)B元素的电负性________D元素的电负性(填“>”、“<”或“=”);用一个化学方程式说明B、D两元素形成的单质的氧化性强弱:_____________________。
(4)B元素的电负性________D元素的电负性(填“>”、“<”或“=”);用一个化学方程式说明B、D两元素形成的单质的氧化性强弱:_____________________。
(5)如图所示是R形成的晶体的晶胞,设晶胞的边长为a cm。试计算R晶体的密度。(阿伏加德罗常数用NA表示)
23.(8分)[化学-有机化学基础]
有机化学反应因反应条件不同,可生成不同的有机产物。例如:

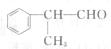 工业上按下列路线合成结构简式为的物质,该物质是一种香料。
工业上按下列路线合成结构简式为的物质,该物质是一种香料。

请回答下列问题:
(1)写出A1,A2可能的结构简式:A1____________________;A2____________________
(2)反应⑤的化学方程式为_________________________________________________
(3)工业生产中,中间产物经反应③④⑤⑥得D,而不是由A1或A2直接转化为D。其优越性主要是_______________________________________________
(4)这种香料有多种同分异构体,写出2种符合下列条件的有机物的结构简式:
a.其水溶液遇FeCl3溶液变紫色;
b.分子中有苯环,且苯环上的一溴代物只有2种。
___________________________,_______________________________
22.(12分)将2 molSO2和1 mol02混合置于容积为2L的密闭容器中,在800 K时,发生如下反应:
2SO2(g)+02(g)  2S03(g) △H=-196.56 kJ·mol-1
2S03(g) △H=-196.56 kJ·mol-1
当反应从开始进行到5 min时,反应达到平衡状态,测得混合气体总物质的量为2.1 mol。
请回答下列问题:
(1)800K时,该反应的平衡常数为______,在0-5 min时间间隔内SO2的反应速率为--。
(2)若在5 min时降低温度,在某一时刻重新达到平衡状态,则新平衡混合物中气体的总物质的量_______2.1 mol(填“>”、“<”或“=”),简述你的判断理由:____________________________________
(3)若相同条件下,向该容器内分别充入xmol SO2、ymol O2和z mol SO3,反应达到平衡时,容器内混合气体总物质的量仍为2.1 mol。则:x、y、z必须满足的关系是_________、_________________(一个用含x、z的式子表示,一个用含y、z的式子表示)
(4)相同条件下,若在上述容器中,充人0.2mol SO2、0.4 mol O2和4.0 mol SO3三种气体,下列对该反应状态的描述中,正确的是__________(填字母序号)。
A.处于平衡状态
B.不是平衡状态,反应正向进行
C.不是平衡状态,反应逆向进行
[选做部分]
21.(14分)下表是A、B、C、D四种有机物的有关信息:

请回答下列问题:
(1)与D在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式 。当n=__________时,开始出现该类有机物的同分异构体。
。当n=__________时,开始出现该类有机物的同分异构体。
(2)在一定条件下,D分子之间能生成一种具有广泛用途的高分子化合物,写出该高分子化合物的名称是______________。
(3)写出A与NH。在一定条件下反应生成丙烯酰胺的化学方程式,并指出反应类型:_________________,反应类型:_________________
(4)丙烯酰胺有多种同分异构体,试写出3种分子中同时含有醛基(一CH0)和碳碳双键( )的同分异构体的结构简式:__________、________、_______
)的同分异构体的结构简式:__________、________、_______
(5)写出B与C反应的化学方程式:_____________________________________
20.(10分)甲、乙、丙为三种常见短周期元素,它们的原子序数依次增大,已知甲元素原子最外层电子数比乙元素原子的多一个,乙元素原子最外层电子数与其电子层数相等,丙元素原子最外层电子数是乙元素原子最外层电子数的2倍。物质A、B属于钠盐,物质C是一种强酸;又知:A中含乙元素,B中含甲元素,C中含丙元素。各种物质之间的相互转化关系如下图所示(部分产物未给出):
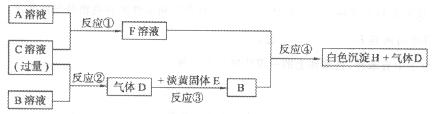
请回答下列问题:
(1)丙元素的原子结构示意图为_________,白色沉淀H的化学式为___________。
(2)反应①的离子方程式为_____________________________。
(3)用离子方程式解释B溶液pH>7的原因:___________________ 。
(4)写出反应③的化学方程式:_______________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com