
11.下列说法正确的是
A.等质量的铝分别与足量稀盐酸、足量烧碱溶液反应时转移的电子数相等
B.36 g水与1.204×l024个O2分子在标准状况下所占的体积相等
C.相同温度时,电离常数相同的两种弱电解质在水中的离子浓度相同
D.pH均为2的硫酸和醋酸溶液稀释相同倍数(如100倍)后溶液的pH相同
 l2.由实验事实得出的结论,其中正确的是
l2.由实验事实得出的结论,其中正确的是
10.下列实验操作中正确的是
A.配制一定物质的量浓度的硫酸溶液时,用量筒量取一定体积的浓硫酸倒人烧杯
后,再用蒸馏水洗涤量筒2-3次,并将洗涤液一并倒入烧杯中稀释
B.玻璃导管与橡皮管连接时,先将玻璃导管蘸水,然后边旋转边向橡皮管中插入
C.用胶头滴管向试管中加入液体时,为防止滴在试管外面,应将滴管尖嘴处伸入
试管口中
D.称量氢氧化钠固体的质量时,将称量物放在纸片上,并置于托盘天平的左盘,
砝码放在托盘天平的右盘
9.在我们日常生活和学习中,常常遇到某些问题涉及化学知识。下列说法不正确的是
A.“墙内开花墙外香”的微观原因是分子的不断运动
B.马铃薯切开后表面很快变为蓝色,这是其中的I-被空气中的氧气氧化为I2,I2
遇淀粉作用造成的
C.医院里检验人是否患有“糖尿病”,就是利用了葡萄糖与氢氧化铜的反应
D.用“糯米酿造米酒”的原理是糯米中的淀粉在酶的作用下发生水解反应
33.(8分)[化学一有机化学基础]

已知:有机物D( )是组成人体蛋白质的氨基酸之一,它可由A通过以上反应合成制取。有机物A(
)是组成人体蛋白质的氨基酸之一,它可由A通过以上反应合成制取。有机物A( )为食品包装中的常用防腐剂,常温下难溶于水;可以使溴水褪色。有机物B(
)为食品包装中的常用防腐剂,常温下难溶于水;可以使溴水褪色。有机物B( ),其分子中没有支链,通常状况下为无色晶体,能与氢氧化钠溶液发生反应。
),其分子中没有支链,通常状况下为无色晶体,能与氢氧化钠溶液发生反应。
试回答下列问题:
(1)B、D的结构简式分别是__________________________
(2)A可以发生的反应有________________________________(选填序号)
①加成反应 ②氧化反应 ③酯化反应 ③加聚反应
(3)B分子中所含的官能团名称是______________________________
(4)B的具有相同官能团的同分异构体的结构简式是______________
(5)写出由B与甲醇反应制A的化学方程式是_____________________
32.(8分)[化学一物质结构与性质]
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
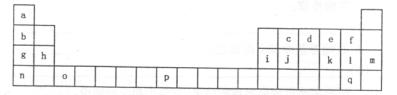
试回答下列问题:
(1)请写出元素O的基态原子电子排布式_________,g元素的价电子的四个量子数依次是_____________________。
(2)d的氢化物中心原子的杂化方式是_________________。
(3)O元素所在族的符号是___________________________。
(4)d的氢化物与l的氢化物反应后的产物中包含的化学键是_________。
(5)f、l、q的氢化物中沸点最高的是_________________________。(写化学式)
(6)j原子形成的晶体与j原子跟c原子以1:1相互交替结合而形成的jc晶体类型相同。则j晶体的熔点_______jc晶涔的熔点(填“大于”“等于”“小于”)原因是:_______。
31.(8分)[化学-化学与技术]
聚合氯化铝晶体的化学式为 ,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣--铝灰,它主要含Al203,Al,还有SiO2 等杂质。聚合氯化铝生产的工艺流程如下:
,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣--铝灰,它主要含Al203,Al,还有SiO2 等杂质。聚合氯化铝生产的工艺流程如下:

(1) 搅拌加热操作过程中发生反应的离子方程式为:
_______________________________________________
(2)生产过程中B和D的操作名称分别是_______和_______(B和D均为简单操作)。
(3)反应中副产品a是_______________________。
(4)生产过程中可循环使用的物质是___________________(用化学式表示)。
(5)调节pH至4.0-4.5的目的是_____________________________________。
(6)实验室要测定水处理剂产品中n和x的值。为使测定结果更准确,需得到的晶体较纯净。生产过程中C物质可选用_____________________________。
(A)NaOH (B)Al (C)氨水 (D)Al203 (E)NaAl02
30.(18分)为了从含有FeCl3、FeCl2、CuCl2的废液中回收Cu.某研究性学习小组的同学们设计了两种方案:
回答下列问题:
(1)根据实验方案的内容和步骤补全下述实验方案中的①②③.
方案1:向废液中加入过量的铁粉,充分反应后,①_________。在所得滤渣中加入足量的②________,充分反应后,再过滤即得到铜。
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解。当观察到③________时,即停止电解,这时要回收的Cu已全部析出。
(2)方案1中涉及的四种阳离子的氧化性由强到弱的顺序为:___________。过滤操作时,需要用到的玻璃仪器是:__________。
(3)方案2中铜作____极,所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出:_______.另一电极所发生的电极反应为__________________。
(4)方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表现为:_____________________________。
[选做部分]
共8个题,考生从中选择2个物理题、1个化学题和1个生物题作答。
29.(14分)(1)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成,而是在反应物到生成物的过程中经过一个高能量的过渡态。图甲是白磷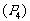 和O2反应生成
和O2反应生成 过程中能量变化示意图,请写出白磷
过程中能量变化示意图,请写出白磷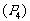 和O2反应生成
和O2反应生成 的热化学方程式__________(△H用含E1和E2的代数式表示,其中
的热化学方程式__________(△H用含E1和E2的代数式表示,其中 E1、E2均大于0)。又知无论温度高低,上述反应都能自发进行,则可从理论上推断上述反应的熵变△S_______________O(填“>”、“<”或“= ”)
E1、E2均大于0)。又知无论温度高低,上述反应都能自发进行,则可从理论上推断上述反应的熵变△S_______________O(填“>”、“<”或“= ”)
(2)常温下取0.2mol/L HCI溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+)________0.2mol/L HCl溶液中由水电离出的c(H+);(填“>”、“<”、或“=”) 。
②求出混合物中下列算式的精确计算结是
c(Cl-)-c(M+)=__________mol/L,c(H+)-c(MOH)=___________mol/L。
③如果常温下取0.2mol/L MOH溶液与0.1 mol/L HCI溶液等体积混合,测得混合溶液的PH<7,则说明MOH的电离程度_________MCl的水解程度。(填“>”、“<”、或“=”)
28.(10分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物已略去)
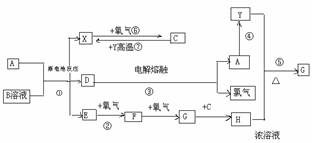
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为_____________
(2)反应②的化学方程式为______________________________________________________
(3)反应⑤的化学方程式为______________________________________________________
(4)原电池反应①中正极的电极反应式为__________________________________________
(5)B溶液在工业上常被用作焊接时的除锈剂,其应用原理是_________________________
15.下列说法中正确的是
A. 25℃时,向CH3COONa溶液中加入适量CH3COOH使混合液PH=7,此时溶液中[Na+]=[CH3COO-]
B.25℃时,0.1 mol·L-1氨水和0.05 mol·L-1氨水中[OH-]之比是2:1
C.体积相同、PH值相同的①盐酸②硫酸③醋酸,被NaOH溶液完全中和,消耗①、②、③溶液的体积由小到大的顺序是②<①<③
D.向含有HC03-、CH3COO-、C032-、S032-离子的溶液中加入足量的Na202固体后,假设溶液体积不变,则以上四种离子浓度基本保持不变的是C032-和CH3COO-
[必做部分]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com