
23.(7 分)CO、CH4均为常见的可燃性气体。
(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是 。
(2)已知在10l kPa时,CO的燃烧热为 283 kJ/mol。相同条件下,若 2 mol CH4完全燃烧生成液态水,所放出的热量为l mol CO完全燃烧放出热量的 6.30 倍,CH4完全燃烧反应的热化学方程式是 。
(3)120℃、101 kPa下,a mL由CO、CH4组成的混合气体在b mLO2中完全燃烧后,恢复到原温度和压强。
①若混合气体与O2恰好完全反应,产生a mL CO2气体,则混合气体中CH4的体积分数为 ;(保留两位小数)
②若燃烧后气体体积缩小了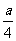 mol,则 a 与 b 关系的数学表示式是
。
mol,则 a 与 b 关系的数学表示式是
。
22.(8 分)工程塑料 ABS 树脂的结构简式为
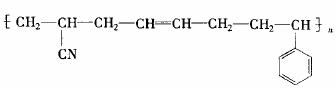
工业制备它的过程如下:
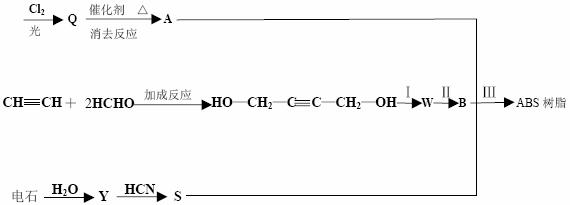
回答下列问题:
(1)有机物的结构简式 X Y B 。
(2)反应类型Ⅰ Ⅱ Ⅲ 。
(3)Q 可能的结构简式为 。
21.(10 分)下图中 A-J 分别代表相关反应中的一种物质,已知 A 分解得到相等物质的量的 B、C、D,图中有部分生成物未标出。
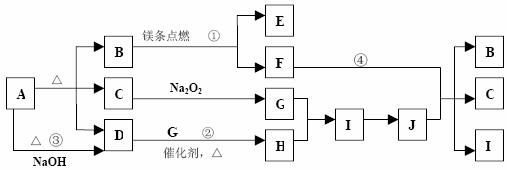
请填写以下空白:
(1)B 的电子式 ,D 分子的空间构型
A 属于 (填离子或共价)化合物。
(2)写出反应②的化学方程式:
(3)写出反应③的离子方程式:
(4)反应④是否为氧化还原反应?如果是,标明电子转移的方向和数目。
20.(6 分)国务院强调,调水必须坚持“三先三后”的原则。在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患。检测某工厂废液中,含有大量的Mg2+、Al3+、 Cu2+、Ag+。试分析回答下列问题:
(1)该废液中可能大量存在的一种阴离子是 。(选填序号)
A.SO42- B.NO3- C.Cl- D.CO32-
(2)为检测废液中铝元素的含量, 需将其从废 水样品中分离出来,所用的试剂可以是 ,铝元素发生变化的离子方程式是
。
(3)为了回收废液中的金属银,某同学设计了如下方案:
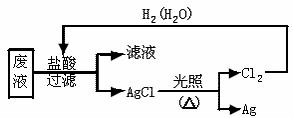
若依该方案获得Ag 108 g,为保证不污染环境和Cl2的循环利用,理论上应提供标准状况下的H2 L。
19.(9 分)甲、乙、丙、丁为前 3 周期元素形成的微粒,它们的电子总数相等。已知甲、乙、 丙为双原子分子或负二价双原子阴离子,丁为原子。
(1)丙与钙离子组成的离子化合物跟水反应产生 1 种可燃性气体,反应的化学方程式是
(2)乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途
(3)在一定条件下,甲与氧气反应的化学方程式是
(4)丁的元素符号是 ,它的原子结构示意图为 。
(5)丁的氧化物的晶体结构与 的晶体结构相似。
l7.(2 分)下列实验方法中,正确的是( )。
①用酒精从碘水中萃取碘 ②用加热方法从碘和砂子的混合物中分离出碘
③实验室制Cl2、HCl和HF都用同一套装置
④用淀摇粉溶直接检验出I-
⑤根据加入AgNO3溶液产生白色沉淀的现象认定溶液中含Cl-
⑥盛放液溴的试剂瓶内放少量蒸馏水防止液溴的挥发
⑦用 KI 和浓硫酸制取 HI
A.①③④ B.②④⑤⑦ C.②⑥ D.全部正确
18.(10 分)某校进行化学实验考查时,教师给了同学们 1 小包黑色粉末,这种黑色粉末可能是氧化铜、炭粉或者是这两种的混合物,让他们通过实验探究来确定。某同学探究过程如下:
(1)提出假设:
假设 1:黑色粉末是炭粉;
假设 2: ;
假设 3:
(2)设计实验方案: 他对实验做了如下设想和分析:取少量黑色粉末于烧杯中,并加入过量的稀硫酸,则实验中可能出现的现象与对应结论如下表,请你完成下表。
|
实验中可能出现的现象 |
结论 |
|
① |
假设 1 成立 |
|
② |
|
|
③ |
假设 3 成立 |
(3)进行实验:通过实验及分析,确定该黑色物质为炭粉和氧化铜的混合物。
(4)拓展:为了进一步探究炭粉和氧化铜的性质,他又利用这种混合物补充做了如下实验:
将此黑色粉末隔绝空气加热(若碳完全反应),待冷却到室温后,取剩余固体于烧杯中,再 加入过量稀硫酸,反应完全后,静置。请你回答:
①烧杯中 (填“有”或“无”)不溶物;
②若静置后溶液呈无色,则该溶液中溶质是 (写化学式);
③若静置后溶液呈蓝色,该反应的化学方程式为:
。
16.已知 25℃ 105Pa时,1 mol C(石墨)完全燃烧生成CO2气体放热 393.5kJ·mol-1,1 mol CO完全燃烧生成CO2气体放热 283.0 kJ·mol-1,下列说法正确的是
A.在 25℃ 105Pa时,石墨燃烧生成CO气体的热化学方程式为
2C(石墨s)+O2(g) =2CO(g) △H=-110.5 kJ·mol-1
B.石墨不完全燃烧,生成CO2和CO混和气体时,放热 283.0 kJ·mol-1
C.石墨固体与CO2气体反应生成CO气体的反应是吸热反应
D.如果在同条件下,1 mol金刚石完全燃烧生成CO2气体放热 395.4 kJ·mol-1,则可以判定金刚石转化为石墨需要吸收热量
第Ⅱ卷(非选择题,共 52 分)
15.不久前,美国一个海军航空站安装了一台250kW的MCFC型燃料电池,该电池可同时供电和水蒸气,其工作温度为为 600℃-700℃,所用燃料为H2,电解质为熔融的K2CO3,已该电池的总反应为:2H2+O2=2H2O
负极反应为:H2+CO32-2e-=H2O+CO2
则下列推断正确的是
A.正极反应为:4OH - = O2+2H2O+4e -
B.放电时CO32-向负极移动
C.电池供应 1 mol 水蒸气,转移的电子数为 4 mol
D.放电时溶液中的CO32-不断减少
14.2005 年 10 月 12 日,我国“神舟”六号载人飞船成功发射。航天飞船是用铝粉与高氯酸铵的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应:
2NH4ClO4 = N2↑+4H2O+Cl2↑+2O2↑;△H<0
下列对该反应的途述不正确的是
A.高氯酸铵的水溶液呈中性
B.该反应中反应物的总能量大于生成物的总能量
C.该反应属于分解反应、氧化还原反应、放热反应
D.反应从能量变化上说,主要是化学能转变为热能
13.某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此无色混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。下列对于原混合气体成分的判断,正确的是
A.肯定有SO2和NO B.肯定有Cl2、O2和NO2
C.可能有Cl2和O2 D.肯定只有NO
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com