
15.下列说法正确的是 ( )
A.常温下,碱性溶液中Na+、I-、ClO-、NO 能大量共存
能大量共存
B.铝片和铜片用导线连接后插入浓HNO3中组成原电池,铝片为原电池的负极
C.常温下,能与水反应的金属不能用H2还原其氧化物的方法来制备

D.化合物 与HBr发生加成反应,所得产物最多有三种
第II卷(必做126分+选做26分,共152分)
[必做部分]
|
MnO2+4H++2Cl- Mn2++Cl2↑+2H2O,也可以利用反应
2KMnO4+16HCl(浓) 2KCl+2MnCl2+5Cl2↑+8H2O制取并收集纯净、干燥的氯气,部分装置如图所示:
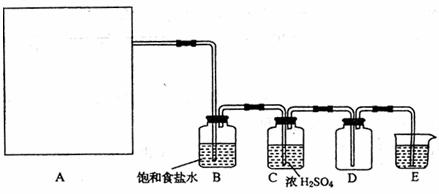
(1)若以KMnO4和浓盐酸为原料制取氯气,请根据反应原理从下图中选择合适的制气装置 (填代号)。

(2)装置B的作用是 。
(3)E中的试剂可选用 (填代号)。
A.NaOH溶液 B.Na2CO3溶液 C.NaCl溶液 D.水
(4)某学生通过下列两种方式制取氯气:
①用8.7gMnO2与足量浓盐酸反应制取Cl2
②用含14.6gHCl的浓盐酸与足量MnO2反应制取Cl2
这两种方式产生Cl2的量的关系是 。
A.①多 B.②多 C.①②一样多
II.现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题:
(1)写出发生反应的离子方程式
 ;
;
(2)实验过程中绘制出生成CO2的体积
[V(CO2)]与时间(t)的关系如图
所示,试分析判断OE段、EF段、
FG段反应速率[分别用 (OE)、
(OE)、
(EF)、 (FG)表示]的大小关系
(FG)表示]的大小关系
;比较OE段和EF段,说明EF段速率变化的主要原因
应该是 。
14. 张老师做了一个如图所示实验,发现烧杯中酸性KMnO4溶液褪色,若将烧杯中的溶液换成含有少量的KSCN的FeCl2溶液,溶液显红色,判断下列说法中正确的是( )
张老师做了一个如图所示实验,发现烧杯中酸性KMnO4溶液褪色,若将烧杯中的溶液换成含有少量的KSCN的FeCl2溶液,溶液显红色,判断下列说法中正确的是( )
A.该条件下生成的水分子化学性质比较活泼
B.该条件下H2被冷却为液态氢,液氢的水
溶液具有还原性
C.该条件下H2燃烧生成了只具有氧化性的物质
D.该条件下H2燃烧的产物中可能含有一定量的H2O2
13. 反应mA(固)+nB(g) pC(g),△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
( )
反应mA(固)+nB(g) pC(g),△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
( )
 ①m+n>p
①m+n>p
②x点表示的正反应速度大于逆反应速率
|
④x点比y点时的反应速率慢
⑤若升高温度,该反应的平衡常数增大
A.①②⑤ B.只有②④ C.只有①③ D.只有①③⑤
12.120℃以上的温度烹制富含淀粉类食品时,会产生致癌物丙烯酰胺,其结构简式如下,它可看作丙烯酸中的一OH被-NH2取代的产物,下列有关叙述不正确的是 ( )
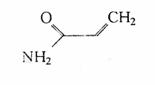 A.其化学式为C3H4NO
A.其化学式为C3H4NO
B.它能使酸性KMnO4溶液褪色
C.它能与酸反应
D.它能发生加聚反应生成高分子化合物
11.a、b、c、d是四种短周期元素,a、b、c同周期,c、d同主族。a的原子结构示意图为:

|
¨ ¨ |
|
A.原子序数:a>b>c B.其单质的活泼性:d>a>c
C.原子半径:c>a>d D.其最高价含氧酸的酸性:d>c>a
|

 A.羟基电子式: O : H B.中子数为14的硅原子
A.羟基电子式: O : H B.中子数为14的硅原子 Si
Si
C.镁离子结构示意图 D.甲烷的分子模型
10.碳酸铵[(NH4)2CO3]是一种常见的化肥,在室温下就能自发的分解产生氨气,下列对其说法中正确的是 ( )
A.碳酸铵分解是因为生成了挥发性物质,使体系的熵增大
B.碳酸铵分解是吸热反应,根据能量变化判断该反应不能自发进行
C.碳酸铵分解是因为与外界没有能量交换
D.碳酸盐都不稳定,都能自发分解
25.(10分)f物质结构与性质]
A、B、C分别代表3种不同的短周期元素。A元素的原子最外层电子排布为ns1;B元素原子的M电子层中有2个未成对电子;C元素原子的L电子层的P亚层中有4个电子。
(1)若A元素的原子最外层电子排布为1s1,B的最高化合价为+6价,则B原子的价电子排布式为______________ ,按原子轨道的重迭方式,A与B形成的化合物中的共价键属于_____________键。
(2)若B的最高化合价为+4价,B的原子结构示意图为_________,B与c形成的晶体中微粒间的作用力是______________,其熔点比干冰的熔点高的原因是_________________。
(3)A元素的原子最外层电子排布为3s1,B的最高化合价为+4价,元素A在周期表中的位置是______________,A、B、C三种元素的第一电离能有大到小的顺序是__________(用元素符号表示)。
 23.(14分)(1)发生原电池的反应通常是放热反应,在理论上可设计成原电池的化学反应是_______(填序号),理由是__________________。
23.(14分)(1)发生原电池的反应通常是放热反应,在理论上可设计成原电池的化学反应是_______(填序号),理由是__________________。
A.C(s)+H20(g)=CO(g)+H2(g) △H>0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH3·H20(l)+8H20(l) △H>0
C.CaC2(s)+2H20(l)=Ca(OH)2(s)+C2H2(g) △H<0
D.CH4(g)+202(g)=CO2(g)+2H20(l) △H<0
(2)以KOH溶液为电解质溶液,依据(1)所选反应设计一个电池,其负极反应为__________。
(3)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与右图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:
①若X和Y均为惰性电极,a为饱和的NaCl溶液,则电解时检验Y电极反应产物的方法是____________________________________________。
②若X、Y分别为石墨和铁,A仍为饱和的NaCl溶液,则电解过程中生成的白色固体物质露置在空气中可观察到的现象为________________________________。
③若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1molCu(0H)2,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为__________________________________________。
[选做部分]
说明:共2个小题,任选一题作答。
24.(10分)[有机化学基础]
由丙烯经下列反应可得到F、G两种高分子化合物,它们都是常用的塑料。

(1)聚合物F的结构简式是__________________。
(2)D的结构简式是________________________。
(3)B转化为C的化学方程式是________________________。
(4)在一定条件下两分子E能脱去两分子水形成一种六元环化合物,该化合物的结构简式是___________________________________________。
(5)E有多种同分异构体,其中一种能发生银镜反应,1 mol该种同分异构体与足量的金属钠反应产生1 mol H2,则该种同分异构体的结构简式为____________________________。
22.(9分)A、B、C、D、E、F六种物质在一定条件下有下图所示的相互转化关系,所有反应物和生成物均已给出。

(1)若反应①、②、③均为水溶液中的置换反应,A、D、E为卤素单质,则A、D、E的化学式分别为____________、_________________、________________。
(2)若B是水,C是生产生活中应用最广泛的金属所对应的一种具有磁性的黑色氧化物,D是相同条件下密度最小的气体,E是一种无色、无味的有毒气体,则反应①的化学方程式是______________________。
(3)若B为一种淡黄色固体,绿色植物的光合作用和呼吸作用可实现自然界中D和E的循环。则反应①的离子方程式是________________________。在反应③中,著生成1 mol D,则转移电子的物质的量为____________________________。
21.(11分)已知A、B、C是第二周期的非金属元素,其原子序数依次增大,且它们之间可以形成AC和BC以及AC2和BC2分子,D元素是一种短周期元素,它与A、B、C可分别形成电子总数相等的三种分子。请回答:
(1)写出工业生产中BD,与氧气反应的化学方程式_______________________________。
(2)你认为B、C、D元素形成的化合物之间能否______(填“能”或“不能”)发生下面的反应BC+BD3→DBC2+D2C,理由是_________________________________________________
(3)由A、C、D三种元素组成的化合物A2D6C在一定条件下可以转化为A2D4C,写出实现该转化的化学方程式____________________________________________________________
(4)①恒温恒压下,在一体积可变的密闭容器中发生下列反应:
4AC(g)+2BC2(g)  4AC2(g)+B2(g)在上述条件下,向容器中充入AC和BC2各1mol达平衡时,生成AC2和B2共a mol,则AC的转化率是__________(用含a的代数式表示)。
4AC2(g)+B2(g)在上述条件下,向容器中充入AC和BC2各1mol达平衡时,生成AC2和B2共a mol,则AC的转化率是__________(用含a的代数式表示)。
②若维持温度不变,在一个与①反应前的起始体积相同且容积固定的密闭容器中发生①中所述的化学反应,开始时仍向容器中充入AC和BC2各1mol,达平衡时生成AC2和B2共b mol,将b与①中的a进行比较,则a _______b(填“>”、“<”、“=”或“不能确定”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com