
3.设NA表示阿伏加德罗常数,下列说法正确的是
A.1L1mol/L CH3COONa溶液中存在NA个CH3COO-离子
B.1molCnH2n+2含有(3n+1) NA个共价键
C.1molCl2参加化学反应获得的电子数都是2 NA
D.1molNO2气体降温后颜色变浅,其所含的分子数仍为NA
2.下列关于原子的几种描述中,错误的是
A.18O与19F具有相同的中子数 B.16O与17O具有相同的电子数
C.12C与13C具有相同的质量数 D.15N与14N具有相同的质子数
1.下列各项中表达正确的是


A.F-的结构示意图: B.乙炔的分子模型示意图:
C.NaCl的电子式: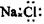 D.乙酸的结构简式:C2H4O2
D.乙酸的结构简式:C2H4O2
20.(10分)[物质结构与性质]
化合物YX2、ZX2中X、Y、Z都是前三周期元素,X与Y同周期,Y与Z同主族,Y元素的最外层中P轨道上的电子数等于前一电子层电子总数,X原子最外层的P轨道中有一个轨道填充了2个电子。则
(1)X原子的电子排布式是 ,Y原子的价层电子轨道表示式是
(2)YX2的分子构型是 ,YX2的熔沸点比ZX2 ,(选填“高”或“低”),理由是
(3)YX2分子中,Y原子的杂化类型是
,一个YX2分子中含
个 键。
键。
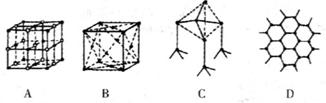
(4)下图表示一些晶体的结构(晶胞),其中代表YX2的是
19.(10分)[有机化学基础]
香豆素内酯分子式为C9H6O2,分子中除有一个苯环外,还有六元环,它可以通过下列合成路线得到:
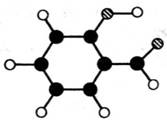

(1)A的分子模型如右图所示(图中球与球之间的连线代表化学键,如单
键、双键):
A的结构简式为 ,A的同分异构体有多种,其中含苯环的同分异构体有 种(不包括A)。
(2)反应③的化学方程式
为 。
(3)现有B和C的混合物nmol,在空气中完全燃烧消耗O2 L,生成CO2aL、H2Obg(气体体积均在标准状况下测定)。若设B、C混合物中含Bxmol,则x的计算式为
18.(16分)I.下图为向25mL0.1mol/L NaOH溶液中逐滴滴加0.2moL/L CH3COOH溶液过程中溶液pH的变化曲线
 请回答:
请回答:
(1)B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确? (选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间内还是BD区间内? (若正确,此问不答)
(2)关于该滴定实验,从下列选项中选出最恰当的一项
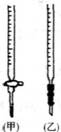
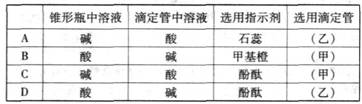
(3)在AB区间内,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)的大小关系是
A.c(OH-)一定大于c(CH3COO-)
B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)
D.c(OH-)可能大于、小于或等于C(CH3COO-)
(4)在D点时,溶液中c(CH3COO-)+c(CH3COOH) 2c(Na+)。(填“>”、“<”或“=”)
Ⅱ.在温度t℃时,某NaOH稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:
(5)该温度下水的离子积常数Kw=
(6)该NaOH稀溶液中NaOH物质的量浓度的精确值是 mol/L(用含字母的表达式表示)
(7)在该温度下(t℃),将100mL 0.1mol/L的稀H2SO4溶液与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=
[选做部分]
说明:共2个小题。任选一题作答。两题均做按第一题给分。
17. (10分)单质A、B、C在常温下均为气态,分别由甲、乙、丙三种短周期元素组成;已知丙元素的原子结构中次外层电子数比最外层电子数多l,化合物D在常温下呈液态,G是常见的金属单质,H是常见的蓝色沉淀。各物质间的转化关系如下图所示(反应条件多数已略去);
(10分)单质A、B、C在常温下均为气态,分别由甲、乙、丙三种短周期元素组成;已知丙元素的原子结构中次外层电子数比最外层电子数多l,化合物D在常温下呈液态,G是常见的金属单质,H是常见的蓝色沉淀。各物质间的转化关系如下图所示(反应条件多数已略去);
请回答:
(1)反应⑥的离子方程式是
(2)甲、乙两元素除形成化合物D外,还可形成一种含有4个原子核和18个电子的化合物,该化合物的电子式是
(3)在反应①中,已知lgB,完全燃烧生成液态D时,放出142.9KJ的热量,则表示B燃烧热的热化学方程式是
(4)反应①也可以设计成原电池装置进行,当用铂作电极,用KOH溶液作电解质溶液时,负极的电极反应式是
(5)反应③④在通常情况下不能自发进行,框图中的条件a是 ,在使反应③④能够发生的装置中,有一个电极材料必须相同,写出该电极反应式
16.(12分)A、B、C、D、E、F六种物质在一定条件下有下图所示的相互转化关系,所有反应物和生成物均已给出。

(1)若反应①、②、③均为水溶液中的置换反应,A、D、E为卤素单质(At除外),则A是
(2)若反应①、②、③均为水溶液中的置换反应,A、D、E为zrI、Fe、Cu中的某种金属,则A是 ,B、C、F三种物质中的阴离子应 (填“相同”或“不同”)。
(3)若B是水,C是生产生活中应用最广泛的金属所对应的一种具有磁性的黑色氧化物,D是相同条件下密度最小的气体,E是一种无色、无味的有毒气体,则反应③的化学方程式是
(4)若B为一种淡黄色固体,绿色植物的光合作用和呼吸作用可实现自然界中D和E的循环。则反应①的离子方程式是 。在反应③中,若生成1mol D,则转移电子的物质的量为 。
15.(10分)类比是化学学习中常用的方法,已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当Cl2足量时生成FeCl3,当铁粉过量时产物是FeCl2,为验证该观点是否正确,该同学将一定量铁粉与Cl2恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下:
请填空:
(1)提出假设:
假设l:该固体物质是FeCl2
假设2:该固体物质是
假设3:该固体物质是
(2)设计实验方案:
取少量固体物质于烧杯中,加适量水溶解,得到溶液A,然后取两份A溶液分别进行实验,实验现象与结论如下表:

(3)根据上述实验结论,写出Cl2与铁粉加热时发生反应的化学方程式
(4)为进一步探究FeCl3溶液的性质,他又利用A溶液做了如下一些实验,其中明显错误的一项是
A.将A溶液滴入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔现象
B.在苯酚溶液中滴加A溶液,呈紫色
C.在A溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将A溶液加热蒸干并灼烧,得到FeCl3固体
(5)取100mLO.2mol/L FeCl3溶液置于烧杯中,向其中加入一定量的Fe、Cu混合物,充分反应后仍有固体剩余,下列叙述一定正确的是 (设溶液体积不变,不考虑水解因素。)
A.烧杯中有Fe无Cu,c(Fe2+)=0.2mol/L
B.烧杯中有Cu无Fe,c(Fe2+)=O.3mol/L
C.烧杯中有Cu无Fe,c(Cl-)=O.6mol/L
D.烧杯中Fe、Cu均有,c(Fe2+)=O.3mol/L
14.广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是:反应中物质和水分别解离成两部分,然后两两重新组合成新的物质。根据上述信息判断,下列说法不正确的是
A.PCl3的水解产物是H3PO4和HCl
B.SiCl4的水解产物是HCl和H4SiO4
C.Mg3N2的水解产物是NH3和Mg(OH)2
D.CaO2的水解产物是Ca(OH)2和H2O2
第Ⅱ卷(非选择题 必做48分+选做10分。共58分)
[必做部分]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com