
26.(8分)煤粉在隔绝空气中加强热,除主要得到焦炭外,还能得到下表所列的物质:
|
序号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
名称 |
甲烷 |
一氧化碳 |
乙烯 |
苯 |
甲苯 |
苯酚 |
氨水 |
(1)表中所列物质不属于有机物的是(填序号): 。
(2)能使溴水褪色的是(填序号): 。
(3)能发生加聚反应、生成物可用作制造食品包装袋的是(填序号) ,该物质发生加聚反应的化学方程式为: 。
(4)能使氯化铁溶液变为紫色的是(填序号): 。
(5)甲苯的一氯取代产物的有 种。
 27.(12分)已知-NH2连在苯环上显碱性 连在苯环上显中性,化学式为C7H7NO2的有机物中其分子结构中有一个苯环,两个侧链(间位),符合下列条件的结构简式为:
27.(12分)已知-NH2连在苯环上显碱性 连在苯环上显中性,化学式为C7H7NO2的有机物中其分子结构中有一个苯环,两个侧链(间位),符合下列条件的结构简式为:
(1)既有酸性又有碱性 ;
(2)只有酸性 ;
(3)只有碱性 ;
(4)显中性 。

(5)由于-COOH能跟-NH2形成 ,所以可用乙二醇、对苯二甲酸跟上述既显酸性又显碱性的物质发生反应,生成高分子化合物[(C17H13NO5)]。该化合物为高强度纤维材料,其结构简式为 。 生成该物质的反应是 反应。
25.(8分)下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
|
a |
|
b |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
c |
d |
|
|
|
|
e |
|
f |
|
|
|
g |
h |
||||||||||
|
|
|
|
|
|
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
j |
⑴i是铁元素,其原子的最外层电子数为2,请写出铁元素的原子结构示意图_________。
⑵以上元素形成的金属单质中,熔点最低的是____ (填元素符号)。
⑶NH3·H2O的电离方程式为NH3·H2O NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是______。(填序号)
NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是______。(填序号)
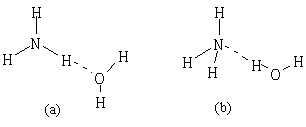
⑷1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是______。(填写元素符号)
⑸利用稀有气体化合物,人们实现了许多制备实验上的突破。如XeO3在一定条件下与NaBrO3反应生成NaBrO4,同时放出Xe。写出上述反应方程式:
_______________________________________________________。
24.(8分)将2 mol SO2和1 mol O2混合置于体积可变的密闭容器中,在T1温度下发生如下反应:
2SO2(g)+O2(g) 2SO3(g)
;△H<0
2SO3(g)
;△H<0
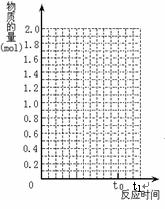 当反应进行到时间t0点时达到平衡状态,测得混合气体的总物质的量为2.1 mol。试回答:
当反应进行到时间t0点时达到平衡状态,测得混合气体的总物质的量为2.1 mol。试回答:
(1)该反应的平衡常数表达式: 。
(2)反应进行到t0时SO2的的体积分数 。
(3)若保持温度为不变,使用催化剂,在图中作出
从反应开始到t0点这段时间SO2物质的量变化曲线。
(4)当反应进行到t1时间时(t1 >t0),给上述反应容器加热到温度为T2 (T2>T1),反应在t2 时间时(t2>t1)重
新达到平衡状 态,新平衡混合物中气体的总物质的量 ______2.1 mol(填“<”、“>”或“=”)。
23、(13分)维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C6H8O6,人体缺乏这种维生素能得坏血症,所以维生素(又称抗坏血酸)。维生素C易被空气中的氧气氧化,在新鲜水果、蔬菜、乳制品中都富含维生素C,如新鲜橙汁中维生素C的含量达500 mg·L-1左右。
某课外活动小组测定了某牌子的软包装橙汁中维生素C的含量。下面是测定实验分析报告(请填写有关空白):
(1)测定目的:测定××牌软包装橙汁中维生素C的含量
(2)测定原理:C6H8O6 + I2 → C6H6O6 + 2H+ + 2I -
(3)实验用品及试剂:
①仪器和用品:(自选,略)
②试剂:指示剂 (填名称)、浓度为7.50×10 -3 mol•L-1标准碘溶液、蒸馏水等。
(4)实验过程:
①洗涤仪器,检查滴定管是否漏液,润洗后装好标准碘溶液,待用;
②打开橙汁包装,目测颜色--橙黄色,澄清度--好。用 (填仪器名称)向锥形瓶中移入20.00 mL待测橙汁,滴入2滴指示剂。
③用左手控制滴定管的 部分,右手摇动锥形瓶,眼睛注视 直到滴定终点,滴定至终点的现象是 。
(5)数据记录与处理:实验时的原始数据记录如下表格:
|
|
样品体积(mL) |
标准碘溶液体积 |
|||
|
滴定前 |
滴定后 |
消耗体积 |
平均值 |
||
|
第一次 |
20.00 |
2.55 |
17.45 |
|
|
|
第二次 |
20.00 |
1.50 |
16.60 |
|
则此橙汁中维生素C的含量是 mg·L-1。
(6)问题讨论:
①滴定时能否剧烈振动锥形瓶?为什么?
答: 。
②从分析数据看,此软包装橙汁是否是纯天然橙汁? (填编号,下同)
A.是 B.不是 C.可能是
制造商可能采取的做法是
A.加水稀释天然橙汁 B.橙汁已被浓缩 C.将维生素C作为添加剂
22.(12分)用示意图中的简易装置可以进行气体的发生和收集。
(1)实验前检查装置的气密性的方法是:
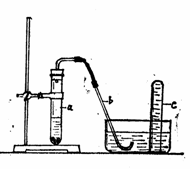 。
。
(2)拔开试管的橡皮塞,加入10 mL 6 mol/L稀
硝酸和 1 g 薄铜片,将带有导管的橡皮塞塞紧试
管口。反应开始时速度缓慢,随着反应的进行逐
渐加快,在试管a中所发生的反应的化学方
程式:① ,
② 。
(3)从反应开始到反应结束,预期在试管a中可观察到象的现象是(依次写出用序号标明):
。
(4)在反应开始时,可观察到导管b中的水面先沿导管b慢慢上升到一定高度,此后又回落,然后有气泡从管口冒出。反应开始时导管中水面上升的原因是:
。
(5)试管c收集满气体后,某同学用橡皮塞堵住管口,取出水槽。将管口朝上,拔开橡胶塞,片刻后,再次堵住管口,将试管又再倒置于水槽中,拔开橡皮塞。此时观察到的现象是: 。
21、(1)(5分)用托盘天平称量NaOH固体的质量时,正确的读数是
A、10g B、10.0g C、10.00g
描述用托盘天平称量上述质量的NaOH固体的操作方法(托盘天平已调平):
。
(2)(4分)下列有关化学实验的操作或说法中,正确的是(填写字母代号)
A、实验室制取肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可得到肥皂
B、进行中和热测定实验时,需要测出反应前盐酸与NaOH溶液的各自温度及反应后溶液的最高温度
C、检验红砖中的氧化铁成分时,向红砖粉末中加入盐酸,放置到充分沉淀后,取上层清液于试管中,滴加KSCN溶液2~3滴即可
D、进行纤维素水解实验时,把一小团脱脂棉放入试管中,滴入少量90%的浓硫酸搅拌,使脱脂棉变成糊状,再加入一定量的水,加热至溶液呈亮棕色,然后加入新制的
Cu (OH)2加热至沸腾即可
20.丁香油酚结构简式如右图所示,下列关于它的性质说法正确的是
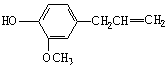 A.既可燃烧,又可使酸性KMnO4溶液褪色
A.既可燃烧,又可使酸性KMnO4溶液褪色
B.可跟NaHCO3溶液反应放出CO2气体
C.在碱性条件下可发生水解反应
D.可与浓溴水发生取代反应
第II卷(非选择题 共80分)
19.下列离子方程式正确的是
A.氯化铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓
B.向Ba(OH)2溶液中逐滴NaHSO4溶液至溶液刚好呈中性
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
C.用氯化铁溶液腐蚀印刷线路铜板:Fe3++Cu=Fe2++Cu2+
D.向碳酸氢钠溶液中滴入过量石灰水:HCO3-+Ca2++OH-=CaCO3↓+H2O
18.物质的量浓度各为0.1mol·L-1的CH3COOH和CH3COONa溶液等体积混合后,溶液呈酸性。下列关系式正确的是
A.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
B.c(CH3COO-)+c(CH3COOH)=0.2mol·L-1
C.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
17. 铊(Tl)是某超导材料的组成元素之一,与铝同族,位于周期表第六周期。Tl3+与银在酸性溶液中发生反应:Tl3+ +
Ag Tl+
+ Ag+ ,下列推断正确的是
铊(Tl)是某超导材料的组成元素之一,与铝同族,位于周期表第六周期。Tl3+与银在酸性溶液中发生反应:Tl3+ +
Ag Tl+
+ Ag+ ,下列推断正确的是
A.Tl+的最外层有1个电子 B.Tl能形成+3价和+1价的化合物
C.Tl3+氧化性比Al3+弱 D.Tl+的还原性比Ag强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com