
18.0.1mol某种元素的单质直接与氯气反应后,质量增加7.1g,则这种元素是
A.Na B.Mg C.Fe D.Cu
17.根据下列化学反应方程式:
(1)2FeCl3+2KI===2FeCl2+l2+2KCI; (2)2FeCl2+C12=2FeCl3
判断下列物质的氧化能力由强到弱的顺序是
A.2FeCl3>C12>I2 B.C12>FeCl3>l2
C.I2>Cl2>FeCl3 D.C12>I2>FeCl3
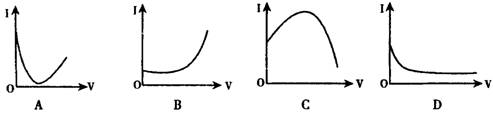
16.向0.1mol·L-1的H2SO4溶液中滴入0.1mol·L-1过量的Ba(OH)2溶液,溶液的导电能力发生变化,其电流强度(1)随加入Ba(OH)2溶液的体积(V)的变化曲线正确的是
15.下列叙述正确的是
A.氯化钠溶液在电流作用下电离成氯离子和钠离子
B.溶于水后电离山氯离子的化合物都是酸
C.硫酸钡难溶于水.但硫酸钡足强电解质
D.氨气溶于水能部分电离,故氨气属于弱电解质
14.欲配制下列四种含大量阴、阳离子的溶液,其中不能配制成功的是
A.Ca2+、K+、Cl-、CO32- B.H+、Na+、OH-、NO3-
C.Mg2+、Ca2+、Cl-、NO3- D.K+、Al3+、Cl-、NO3-
13.下列关于研究物质性质的基本程序的重要环节叙述正确的是
A.观察物质的外观性质→预测物质的性质→实验和观察→解释及结论
B.预测物质的性质→观察物质的外观性质→实验和观察→解释及结论
C.观察物质的外观性质→实验和观察→预测物质的性质→解释及结论
D.预测物质的性质→实验和观察→观察物质的外观性质→解释及结论
12.NA表示阿伏加德罗常数的值,下列关于0.2mol·L-1的Ba(NO3)2溶液的说法不正确的是
A.2L溶液中有阴、阳离子总数为0.8NA
B.500mL溶液中NO3-离子浓度为0.2mol·L-1
C.500mL溶液中Ba2+离子浓度为0.2mol·L-1
D.500mL溶液中NO3-离子总数为0.2NA
11.在实验中手不慎被玻璃划破,可用FeCl3溶液应急止血,其主要原因可能是
A.FeCl3溶液具有杀菌消毒作用
B.Fecl3溶液能使血液凝聚
C.FeCl3溶液能产生Fe(OH)3沉淀堵住伤口
D.FeCl3溶液能使血液发生化学变化
10.金属钠与下列物质的溶液反应,既有沉淀生成又有气体放出的是
A.Mg(NO3)2 B.HNO3 C.Na2SO4 D.NH4Cl
9.下列三个反直中:
①H2O2+H2S=2H2O+S↓;②2H2O2=2H2O+O2↑;③H2O2+Cl2=2HCl+O2↑,过氧化氢所起的作用是
A.起相同作用 B.起不同作用
C.只起氧化剂作用 D.只起还原剂作用
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com