
2.下列反应的离子方程式书写正确的是 ( )
A.向饱和碳酸氢钙溶液中加入饱和氢氧化钙溶液
Ca2++HCO3-+OH-=CaCO3↓+H2O
B.金属铝溶于氢氧化钠溶液 A1+2OH-=A1O2-+H2↑
C.用氢氧化钠溶液吸收过量二氧化碳 2OH-+CO2=CO32-+H2O
D. Fe2(SO4)3的酸性溶液中通入足量的硫化氢:Fe3++H2S=Fe2++S↓+2H+
1.第116号元素假如于2008年被发现。若IUPAC(国际纯粹与应用化学联合会)推荐该
元素的符号为Ch,以纪念该元素的发现地(China,中国)。下列关于Ch的说法正确的
是 ( )
A.Ch的最高价氧化物的水化物是强酸
B.Ch是超铀元素,其原子的质量数为116
C.Ch的氧化物有两种,即ChO2和ChO3,其钠盐的化学式为Na2Ch
D.Ch原子核外的电子层数为7,且是金属元素
24.(12分)在实验室中进行合成氨工业的模拟实验,当反应进行一段时间,并建立相应的平衡以后,及时分离出氨并补充与起始原料比相同的氮气和氢气,以实现连续的生产过程,在1L的密封容器中,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g);ΔH<0
2NH3(g);ΔH<0
请根据图示回答下列问题:
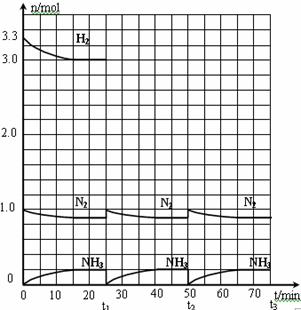
⑴反应起始时,氮气与氢气的物质的量之比
n(N2)∶n(H2)=_____∶_____。
在15分钟时合成氨反应第一次达到平衡,其间以H2的浓度变化所表示的平均化学反应速率为______________________。
⑵在t1时,曲线发生变化的原因是__________________、______________________。
请计算氢气在t1起点时的坐标(______,______)以及在t2平衡时的坐标(_______,________)。并在图中画出在t1-t2之间氢气的物质的量变化曲线。
⑶为达到图示中t2的平衡状态,在t1-t2之间需要采取的措施是_____________。
a.扩大容器的体积 b.升高温度 c.降低温度 d.缩小容器的体积
⑷经历十次上述的循环过程,计算在t11达到平衡时,N2和H2的物质的量之比n(N2)∶n(H2)=____∶____,整个过程中N2和H2的总转化率之比a(N2)∶a(H2)=____∶____。
⑸根据以上计算结果,请你建议合成氨反应的最佳原料比是:n(N2):n(H2)=______。
23.(6分)将一块金属钠投入到100mLMgCl2和AlCl3的混合溶液中,发现沉淀先多后少。反应完毕后收集到13.44L气体(标准状况下),同时得到21.4g白色沉淀,将此沉淀溶于过量的NaOH溶液中,充分反应后沉淀质量减轻了15.6g。求原溶液中Mg2+、Al3+的物质的量浓度。
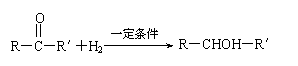
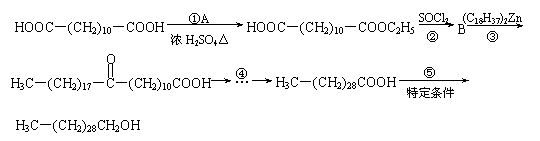
22.(10分)三十烷醇是一种优良的植物生长调节剂,有促进种子萌芽,促进植物根系发育和叶绿素的合成等多种功能。工业上以十二二酸为原料合成三十烷醇的过程如下:
|
|



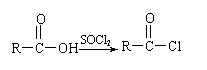


已知:
请回答下列问题:
⑴B物质的结构简式________。
⑵写出转化①的化学方程式_________________________;反应类型是___________。
⑶若转化④是通过若干个反应完成的,请设计由C→D的转化途径(用化学方程式表示):
21.(8分)现有饱和一元醇的混合物和饱和一元羧酸的混合物在一定条件下反应生成多种酯的混合物,酯的相对分子质量分别为M1,M2,M3,并依次增加14。经分析,相对分子质量为M2的酯,其氧元素所占的质量分数为31.4%,并有三种酯的同分异构体。请回答:
⑴相对分子质量为M2的酯的化学式为________________。
⑵饱和一元羧酸的化学式分别为_________________,__________________。
⑶参加反应的醇结构简式为_________、_________、___________、___________(不必填满)。
⑷与相对分子质量为M1的酯互为同分异构体,能发生银镜反应、能与金属钠反应产生氢气的有机物的同分异构体有_____种。
20.(14分)有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物;B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物。
⑴写出只含有A、B、D、E四种元素的两种无水盐的化学式 、 。
⑵右图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示 ,与每个“构成粒子”相邻的粒子呈 空间构型。E与D按原子个数比1﹕1形成的化合物的电子式为 。
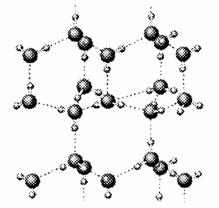
⑶人们通常把拆开l mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
|
化学键 |
F-D |
F-F |
B-B |
F-B |
C═D |
D═D |
|
键能/kJ·mol-1 |
460 |
176 |
347.7 |
347 |
745 |
497.3 |
①下列三种物质形成的晶体,熔点由高到低的顺序(用a、b、c表示):
a.F与B形成的化合物 b.B与D形成的稳定化合物 c.F的单质
②试估算F单质晶体的燃烧热: 。
19.(10分)如下图所示,各物质间存在如下相互转化关系,其中F为常见的金属,高温下与某些金属氧化物反应,是工业冶炼金属的方法之一。A为无色气体,B为淡黄色固体,C为无色液体。E和K为无色气体单质,其它物质均为化合物。
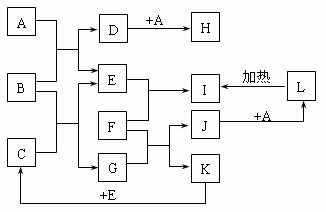
试回答下列问题:
⑴写出下列物质的化学式:A:__________ F:___________
⑵写出G的电子式_______________;A属于__________(填“极性”或“非极性”)分子。
⑶写出J→L的离子反应方程式__________________________________________。
18.(8分)随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。已知钒的原子序数为23,回答下列问题:
⑴钒被认为是一种稀土元素,广泛分散于各种矿物中,钾钒铀矿中的化学式为K2H6U2V2O15(其中钒元素的化合价为+5价)。若用氧化物的形式表示,该化合物的化学式为______。
⑵测定钒含量的方法是先把钒转化成V2O5,V2O5在酸性溶液里转变成VO2+,再用盐酸、硫酸亚铁、草酸等测定钒。请配平下列反应的化学方程式。
___VO2++____H2C2O4→___VO++___CO2+___H2O
其中还原剂是____;若反应消耗0.9g草酸,参加反应的钒元素质量是____g。
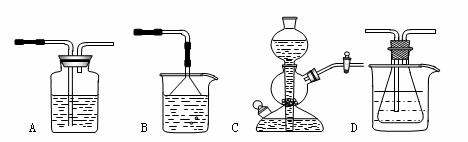
17.(14分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。
他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱。以下A、B、C、D四个装置可组装成实验室模拟“侯氏制碱法”制取NaHCO3的实验装置。装置中分别盛有以下试剂:B:稀硫酸C:盐酸、碳酸钙D:含氨的饱和食盐水、水
四种盐在不同温度下的溶解度(g/100g水)表
|
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
||||
|
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
39.8 |
||||
|
NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
-① |
- |
- |
- |
||||
|
NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
- |
||||
|
NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.3 |
77.3 |
(说明:①>35℃NH4HCO3会有分解)
请回答以下问题:⑴装置的连接顺序应是_______________(填字母)。
⑵A装置中盛放的试剂是_____________________,其作用是_____________________。
⑶在实验过程中,需要控制D温度在30℃-35℃,原因是_____________________________ ________________________。为了便于控制此温度范围,采取的加热方法为___________。
⑷反应结束后,将锥形瓶浸在冷水中,析出NaHCO3晶体的原因是_____________________。用蒸馏水洗涤NaHCO3晶体的目的是除去_______________________杂质(以化学式表示)
⑸将锥形瓶中的产物过滤后,所得的母液中含有_________________________(以化学式表示),可加入氯化氢,并进行_________操作,使NaCl溶液循环使用,同时可回收NH4Cl。
⑹测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品Wg,放入锥形瓶中加蒸馏水溶解,加1-2滴酚酞指示剂,用物质的量浓度为c(mol/L)的HCl溶液滴定至溶液由红色到无色(指示CO32―+H+=HCO3―反应的终点),所用HCl溶液体积为V1 mL,再加1-2滴甲基橙指示剂,继续用HCl溶液滴定溶液由黄变橙,所用HCl溶液体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com