
1.四氯乙烯对环境有一定的危害,干洗衣服的干洗剂主要成分是四氯乙烯;家用不粘锅内侧涂覆物质的主要成分是聚四氟乙烯。下列关于四氯乙烯和聚四氟乙烯的叙述中正确的是
A 它们都属于纯净物 B 它们的分子中都不含氢原子
C 它们都能使酸性高锰酸钾溶液褪色 D 它们都可由乙烯只发生加成反应得到
20、(14分)某化学课外小组设计了如下图所示的实验装置,进行气体性质实验.图中箭头表示气体流向.A表示一种纯净、干燥的气体,B是另一种气体,反应进行一段时间后,装置乙中有红棕色气体生成.实验中所用的药品和干燥剂只能从下列物质中选取: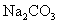 、
、 、
、 、
、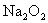 、NaCl、无水
、NaCl、无水 、
、 、碱石灰等固体和
、碱石灰等固体和 、蒸馏水.
、蒸馏水.

根据图中装置和反应现象请回答:
(1)充分反应后丙中无固体剩余,发生反应的化学方程式为______
(2)丁中的干燥剂应选 ________,不选另一种干燥剂的理由是________.
(3)甲中发生反应的化学方程式为___________
(4)观察到反应开始后,断开电键K,铂丝能继续保持红热,戊中发生的主要反应的化学方程式为_________ ___________,此反应是(吸热、放热)________反应.
(5)当己中充满红棕色气体后,停止给丙加热,并关闭a、b两个活塞,若将已浸入冰水中,则己中会出现的现象是_________,简述产生此现象的原因___________.
18、(10分)根据下列框图关系填空,已知①③反应是工业生产中的重要反应,D、E常温下是气体,X常温下为无色液体,H的相对分子质量比E大34,又知C的颜色反应呈黄色。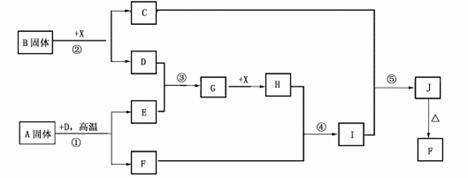 (1)化合物A中所包含的化学键有:_______________________________。
(1)化合物A中所包含的化学键有:_______________________________。
反应③在化工生产中的适宜条件是____________________________. (2)反应④的离子方程式:_______________________________, 反应⑤的化学方程式:_______________________________________。 (3)已知每生成16 g E,放出106.5 kJ热量,则反应①的热化学方程式为:__________。
19(12分).现有A、B、C、D四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,C和D结合生成化合物丁,B、C两种元素的单质和甲、乙、丙、丁四种化合物的转化关系如图:C和D结合生成化合物丁。B、C、D三种元素的单质和甲、乙、丙、丁四种化合物的转化关系如图:
又知甲、乙、丙分子中均含有10个电子,且甲可腐蚀玻璃。
(1)根据以上条件,可以确定A、B、C、D四种元素中的三种,不能被确定的第四种元素是 (填写选项的编号)①A ②B ③C ④D,写出转化关系图中已确认的反应的化学方程式:
(2)写出C+丙→乙+丁可能的一个化学方程式_________________________________
(3)以下四个补充条件中的任何一个都可以进一步确定第四种元素,其中一个条件推断出的第四种元素与其余三个条件推断出的第四种元素不同,这个条件是 (填序号),根据该条件推断出的另一种元素在周期表中的位置为___________________,这四种元素的非金属性由强到弱的顺序为____________________(用相应的元素符号表示)
①化合物甲与丙、乙与丙均能够发生反应
②化合物甲、乙、丙都是无色物质,其中只有甲有刺激性气味
③通常情况下乙和丁不发生反应,若将乙、丁、单质C混合,立即发生化合反应
④单质C和化合物丁不能共存
17.(8分)随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。已知钒的原子序数为23,回答下列问题:
(1)钒被认为是一种稀土金属,广泛分布于各种矿物中,钾钒铀矿的化学式为K2H6U2O15(其中钒元素的化合价为+5价),若用氧化物的形式表示,该化合物的化学式为__________.
(2)测定钒含量的方法是先把钒转化为V2O5,V2O5在酸性条件下转化为VO2+,再用盐酸、硫酸亚铁、草酸等测定钒.请配平下列化学方程式:___VO2++___H2C2O4→___VO++___CO2+___H2O,
其中还原剂是_________,若反应消耗0.9g草酸,则反应过程中转移的电子数目为________.
16.向1L0.6mol/LNaOH溶液中通入8.96L(标况)CO2后,下列说法正确的是( )
A.反应后溶液中溶质只有NaHCO3
B.在该溶液中滴加AlCl3溶液无气体产生
C.溶液中离子浓度由大到小的顺序为:Na+>CO32->HCO3->OH->H+
D.溶液蒸干并灼烧后得纯净物
15.碱性电池具有容量大、放电电流大的特点,锌- 锰碱性电池以氢氧化钾溶液为电解液,电池总反应为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )
A、电池工作时,锌失出电子
B、电池工作时,电子由负极通过外电路流向正极
C、电池正极的电极反应为:2Mn2O3(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq)
D、外电路中每通过0.1mol电子,锌的质量理论上减少6.5g
14.下列反应的离子方程式正确的是( )
A.将氢碘酸加入到Fe(OH)3中:Fe(OH)3+3H+=Fe3++3H2O
B.碳酸氢钙溶液中加入少量烧碱:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C.锌与1mol/L的硝酸溶液反应:Zn+2H+=Zn2++H2↑
D.向氢氧化钡溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+NH4++H++SO42-=BaSO4↓+H2O+NH3·H2O
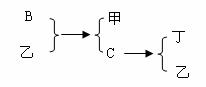
13. 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,可发现试管①内的水立刻沸腾了.则液体A和气体B的组合不可能是下列的( )
 A.氢氧化钠溶液、二氧化碳
A.氢氧化钠溶液、二氧化碳
B.水、氨气
C.氢氧化钠溶液、一氧化碳
D.水、 二氧化氮
12.下列说法正确的是( )
A.PCl5中所有的原子都满足最外层8电子结构 B. 属于化学变化
属于化学变化
C.质子数相等,电子数也相等的两种微粒可能是不同的离子
D.CaF2和Na2O2的化学键种类和晶体类型完全相同
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com