
4.下列说法正确的是
A.H与D,16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体;
甲醇、乙二醇和丙三醇互为同系物
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.HI的相对分子质量大于HF,所以HI的沸点高于HF
D.由IA族和VIA族元素形成的原子个数比为1:1、电子总数为38的化合物,是含有共价键的离子型化合物
3.下列工业生产中,关系式正确的是
A.合成漂白粉:Cl2-Ca(ClO)2 B.合成H2SO4:FeS2-2H2SO4
C.合成氨:C-H2-2/3 NH3 D.合成HNO3:NH3-2/3HNO3
2.臭氧分子的结构与SO2(极性分子)相似,可读做二氧化氧,在臭氧层中含量达0.2 ppm(ppm表示百万分之一)。臭氧是氧气吸收了太阳的波长小于242 nm的紫外线形成的,
不过当波长在220 nm-320 nm的紫外线照射臭氧时,又会使其分解。下列说法中不正确的是
A.打雷时也能产生臭氧,臭氧分子是直线型分子
B.臭氧的氧化性比氧气强,臭氧分子具有的能量比氧气高
C.臭氧和氧气的相互转化能保持大气中臭氧的含量基本稳定
D.向大气中排放氮的氧化物和氟氯代烃均能加快臭氧的分解
1. 2005年4月22日是第36个“世界地球日”,我国国土资源部确定今年“世界地球日”的主题为“善待地球-科学发展,构建和谐”。你认为下列行为中不符合这一主题的是
A.开发太阳能、水能、风能、可燃冰等新能源、减少使用煤、石油等化石燃料
B.控制含磷剂的生产和使用,防止水体富营养化,保护水资源
C.研究采煤、采油新技术,尽量提高产量以满足工业生产的快速发展
D.实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle)
17.(10分)向100mL BaCl2、AlCl3、FeCl3的混合溶液A中逐滴加入Na2SO4和NaOH的混合溶液B,产生沉淀的物质的量n和加入溶液B的体积关系如下图所示:

(1)当加入110mL B溶液时,溶液中的沉淀是 (填化学式)。
(2)溶液B中Na2SO4和NaOH的物质的量浓度之比是 。当B溶液加到90mL-100mL这一段时间中,所发生的离子反应方程式是 。
(3)将A、B溶液中各溶质的物质的量浓度(c)填入下表中。
|
溶质 |
Na2SO4 |
NaOH |
BaCl2 |
AlCl3 |
FeCl3 |
|
c/mol·L-1 |
|
|
|
|
|
16.(10分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转
化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)
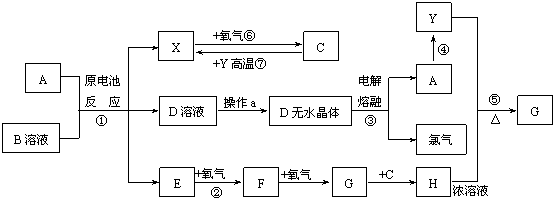
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
______________________________________________________________________;
(2)从D溶液制备D的无水晶体的“操作a”为____________________________;
(3)反应②的化学方程式为_______________________________________________;
(4)反应⑤的化学方程式为_______________________________________________;
(5)原电池反应①中正极的电极反应式为___________________________________.
15.(8分)在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧进行如图所示的反应(均加有适量的新型固体催化剂,其体积可忽略不计)

⑴若其始时左侧投入2molSO2、1molO2,右侧投入1molN2、4molH2,达到平衡后(两侧温度相同),隔板是否可能仍处在中央 (填“可能或不可能”)
⑵起始时投入2molSO2、1molO2;1molN2、2molH2,达到平衡后,隔板仍处于中央,则SO2的转化率和N2的转化率之比为 (填数字)
⑶若起始时投入2molSO2、1molO2;1molN2、amolH2、0.1molNH3,起始时右侧体积小于左侧体积,当a值在一定范围内变化时,均可通过调节反应器温度,使左右两侧反应都达到平衡,且平衡时隔板处于中央,此时SO2的转化率与N2的转化率之比为5:1,求a的取值范围
⑷若起始时投入2molSO2、1molO2,欲用简单方法粗略测定平衡时SO2的转化率,则可将左侧的平衡混合气体中通入足量的 (填序号)
A.碳酸钠与碳酸氢钠混合溶液 B.氯化钡溶液
C.98.3%的浓硫酸 D.硝酸钡混合溶液
14.(8分)(1) 室温下取0.2mol·L-1盐酸与0.2mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
① 混合液中水电离出的c(H+)____原盐酸中水电离出的c(H+);(填“>”、“<”、或“=”),
② 求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+) = __________ mol·L-1
c(H+)-c(MOH) = ___________ mol·L-1
(2)室温下如果取0.2mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则溶液中各离子浓度由大到小的顺序为
13.( 16分)某研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:
一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;
二是发生双水解反应:2Fe3++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3。
为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
[实验Ⅰ]学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,作者设计这个实验的目的是:
。
[实验Ⅱ]取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色“液体”是 。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是: ;溶液变为黄色;有气泡产生。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生血红色现象的离子方程式是 。
[实验Ⅲ]换用稀释的FeCl3和Na2SO3溶液重复实验,Ⅱ、Ⅲ产生的现象完全相同。由上述实验得出的结论是 。
若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是 。
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
① ;
② 。
12.某烃的结构简式为 CH2=CH-C≡C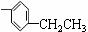 ,下列有关其几何结构的说法正确的是
,下列有关其几何结构的说法正确的是
A.所有碳原子不可能在同一平面上 B.所有碳原子在同一平面上
C.有5个碳原子在同一直线上 D.有6个碳原子在同一直线上
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com