
2、一定条件下,碘单质与砹单质以等物质的量进行反应,可得AtI。它与Zn、NH3都能发生反应,化学方程式分别如下:2AtI+2Zn==ZnI2+ZnAt2 AtI+2NH3(l)==NH4I+NH2At。
下列关于AtI性质的叙述正确的是 ( )
A.ZnI2既是氧化产物,又是还原产物
B.ZnAt2既是氧化产物,又是还原产物
C.AtI与液氨反应,AtI既是氧化剂,又是还原剂
D.AtI与液氨反应,是自身氧化还原反应
1、我国科学家为一个比头发丝还细的小分子恢复了磁性,由此创造了一项“世界第一”。实验时将一种名为“钴酞菁”的小分子搬上了“手术台”。这个“个头”仅为1.3纳米的小分子,其结构和性质与人体内的血红素及植物体内的叶绿素非常相似,在光电子器件、生物技术等方面具有广泛而重要的应用与研究价值。下列说法正确的是 ( )
A.“钴酞菁”的小分子具有胶体的性质
B.纳米材料可以应用于所有化工领域
C.现在纳米器件都是无所不能的胶体
D.此工作实现了利用局域的化学反应来改变和控制分子的物理性质
25.有NH4HCO3、NH4Cl、Na2CO3·xH2O的混合物11.62g,加入44mL5mol·L-1NaOH溶液(过量),共热充分反应,让放出的气体通过碱石灰,结果收集到的气体是3.36L(标准状况)。向溶液中加入30mL2.5mol·L-1硫酸,并稍加热,使气体完全放出,收集到的气体是1.344L(标准状况)。把反应后的溶液稀释到100mL,测得溶液的pH为1。求:
(1)x值。
(2)混合物中各物质的质量。
24.已知5.000g样品内含Fe3O4、Fe2O3与惰性物质,此样品用过量的KI溶液处理后,能使所有的铁还原成Fe2+。然后把溶液稀释到50.00mL,从50.00mL此溶液中取出10.00mL溶液,其中的碘要用5.50mL1.000mol·L-1的Na2S2O3溶液滴定(I2+2Na2S2O3=2NaI+Na2S4O6)。另取25.00mL上述溶液,先除去碘,然后溶液中的Fe2+可以被3.20mLl.000mol·L-1的酸性KMnO4溶液滴定。
(1)KMnO4在酸性溶液中滴定Fe2+的离子方程式为 。
(2)原样品中Fe3O4、Fe2O3的质量分数分别为 和 。
23.如图Ⅰ,在恒压密闭容器M中加入2 molA和2 molB,起始时容器体积为VL,发生如下反应并达到化学平衡状态:2A(?) + B(?) xC(g);ΔH<0。平衡时A、B、C的物质的量之比为1∶3∶4,C的物质的量为y mol。
xC(g);ΔH<0。平衡时A、B、C的物质的量之比为1∶3∶4,C的物质的量为y mol。
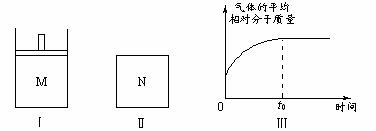
(1)根据题中数据计算,x = 、y = ;
(2)如图Ⅱ,在体积为VL的恒容密闭容器N中发生上述反应(其它条件相同),测得反应过程中气体的平均相对分子质量随时间的变化如图Ⅲ(t0时达平衡),平衡时容器中C的物质的量为z mol。由于反应物A、B的状态未知,则z和y的大小也不确定,请在下表中填入A、B的状态与z、y的大小之间的关系(仿照情形①、可不填满):
|
可能的情形 |
A、B是否为气态 |
z与y的大小关系 |
M(B)与M(C)的大小关系 (M表示摩尔质量) |
|
|
A |
B |
|||
|
① |
是 |
不是 |
z = y |
前面的结论与此无关 |
|
② |
|
|
|
|
|
③ |
|
|
|
|
|
④ |
|
|
|
|
22.请根据以下题目的要求,完成相关问题:
(1)在BaCl2溶液中通入SO2气体无沉淀产生,然后将另一种气体A通入BaCl2溶液中,产生白色沉淀,则A可以是 、 、 、 (要求填二种化合物和二种单质的化学式)。写出一种化合物A与上述溶液反应的化学反应方程式 。
(2)已知可溶性硫化物在溶液中能与硫单质反应生成可溶性的多硫化物(如Na2Sn)。在浓Na2S溶液中滴入少量氯水,经振荡,未发现生成沉淀物,其原因是(只要求写出反应的离子方程式,下同) , ;
在足量氯水中,滴入少量Na2S溶液,经振荡,也未发现生成沉淀物,若再加用盐酸酸化的BaCl2溶液,即可产生白色沉淀,其原因是 。
21.下图为一些物质间的转化关系,其中一些转化过程的条件和某些生成物已略去。已知B为无色液体,C、D、H、N……等为单质,反应③是工业上制取单质H的反应。
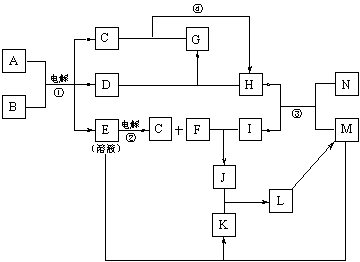
(1)写出反应③、④的化学方程式: 、
。
(2)在固态时,物质E、H、M、I、G、K中,与A的晶体类型相同的有 (写相应的化学式)。
(3)物质G的电子式为 。
(4)用离子方程式表示物质K溶液不显中性的原因 。
(5)上述物质的转化中,有一些对生产科技的发展有着重要的意义,请简单加以说明。
。
20.A、B、C、D均为短周期不同主族的元素,分别属于三个不同的周期且原子序数依次增大。A、C可形成原子个数比分别为1∶1和2∶1的两种化合物。A与B能形成一种使湿润红石蕊试纸变蓝的气体X,A与D能形成酸性气体Y。A、B、C能形成一种离子化合物,其水溶液成弱酸性,请写出:
(1)D的元素符号 ,X跟Y反应的化学方程式 。
(2)用化学用语解释A、B、C形成的化合物水溶液呈弱酸性的原因
。
(3)铋(Bi)跟D元素能形成化合物(BiD3),其水解生成难溶于水的(BiOD)。
①BiD3水解反应的化学方程式为 。
②把适量的BiD3溶于含有少量Y的水中,能得到澄清溶液,试分析可能的原因。
。
③医药上把BiOD叫做“次某酸铋”,分析这种叫法是否合理? 。若认为不合理,请说明理由, 。(若认为合理,此空可不作答)。
19.在两支试管中分别加入3mL2mol·L-1的稀盐酸,将两个各装有0.3gNaHCO3和0.3g Na2CO3粉末的小气球分别套在试管口。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到的现象如下:
(1)试管中(填产生沉淀或气体及反应速率等相关现象) 。
(2)盛 的试管中气球变得更大,大小气球体积之比约为 (填最简单整数比)。
(3)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有所升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。类似如中和热,甲同学写出了下列热化学方程式:
HCO3-(aq)
+ H+(aq) H2O(l) + CO2(g);△H>0
H2O(l) + CO2(g);△H>0
CO32-(aq)
+ 2H+(aq) H2O(l) + CO2(g);△H<0
H2O(l) + CO2(g);△H<0
甲同学下结论的方法是否正确 (填“正确”或“不正确”)。
(4)为研究上述反应是吸热还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
|
序号 |
试剂1 |
试剂2 |
混合前温度 |
混合后最高或最低温度 |
|
① |
35mL水 |
2.5g NaHCO3固体 |
20℃ |
18.5℃ |
|
② |
35mL水 |
3.2 Na2CO3固体 |
20℃ |
24.3℃ |
|
③ |
35mL稀盐酸 |
含2.5g NaHCO3的饱和溶液32.5mL |
20℃ |
19℃ |
|
④ |
35mL稀盐酸 |
含3.2g Na2CO3的饱和溶液23.1mL+10ml水 |
20℃ |
24.2℃ |
|
⑤ |
35mL稀盐酸 |
2.5gNaHCO3固体 |
20℃ |
16.2℃ |
|
⑥ |
35mL稀盐酸 |
3.2g Na2CO3固体 |
20℃ |
25.1℃ |
请你帮助填写相关内容:
该研究报告的题目是《 》;
该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为 和 ;
通过上述实验可得出五条结论:
a:NaHCO3的溶解是 (填“吸热”或“放热”,下同)过程;
b:Na2CO3的溶解是 过程;
c:NaHCO3的饱和溶液和盐酸的反应是 反应;
d:Na2CO3的饱和溶液和盐酸的反应是 反应;
e:NaHCO3固体与稀盐酸反应的反应热是由 (填a→d的字母)的热效应之和。
18.以下是测定食醋中醋酸浓度的实验:
①首先配0.10mol·L-1NaOH溶液1L
②取5mL食醋稀释至50mL
③取稀释后的食醋10mL放入锥形瓶中,滴入指示剂
④用NaOH标准液进行滴定
⑤滴定重复进行三次,求出滴定中所用标准液体积的平均值。根据以上操作,回答下列问题:
(1)从下列选项中选出①、③操作中需要仪器,用序号回答:① ;③ 。
a.表面皿 b.容量瓶 c.碱式滴定管 d.移液管
e.烧杯 f.烧瓶 g.胶头滴管
(2)设⑤中所得平均值为7.50mL,则食醋中醋酸的物质的量浓度为 mol·L-1;若食醋的密度为1.0g·cm-3,则食醋的质量分数为 。
(3)如果滴定管用水洗净后,未用标准液润洗,则食醋的浓度 ;如果锥形瓶用水洗净后,用待测液润洗,则食醋的浓度 (填“偏高”“偏低”或“无影响”)。
(4)该实验选用的指示剂最合适的是 。
A.甲基橙 B.酚酞 C.石蕊
(5)滴加的指示剂溶液的量是 。
A.1~2mL B.2~3mL C.2~3滴
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com