
12、某密闭密闭容器中进行如下反应:X(g)+2Y(g)  2Z(g),若要使平衡时反应物总物质的量与生成物的物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足
( )
2Z(g),若要使平衡时反应物总物质的量与生成物的物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足
( )
A.1<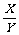 <3
B.
<3
B. <
<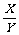 <
<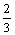 C.3<
C.3<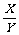 <4 D.
<4 D. <
<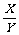 <
<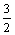
11、 干燥剂的干燥性能可用干燥效率(1m3空气中实际余留水蒸气的质量)来衡量。某些干燥剂的干燥效率数据如下:
|
物质 |
干燥效率 |
物质 |
干燥效率 |
|
MgO |
0.008 |
ZnCl2 |
0.8 |
|
CaO |
0.2 |
ZnBr2 |
1.1 |
分析以上数据,下列有关叙述错误的是
A.MgO的干燥性能比CaO好
B.干燥效率可能与干燥剂的阴、阳离子的半径大小有关
C.MgCl2可能是比CaCl2更好的干燥剂
D.上述干燥剂中阳离子对干燥性能的影响比阴离子小
10、下列离子方程式书写正确的是
A、NaHSO3溶液显酸性是因为:HSO3-==SO32-+H+
B、.四氧化三铁粉末溶于足量的稀HNO3:Fe3O4+8H+=2Fe2++Fe3++4H2O
C、电解饱和食盐水时阴极电极反应式为:2H++2e-==H2↑
D、1L2mol/L的FeBr2溶液中通入2.5molCl2:2Fe2++4Br-+3Cl2==6Cl-+2Fe3++2Br2
9、设No为阿伏加德罗常数的值,下列叙述中不正确的是 ( )
A、12.4g白磷晶体中含有的P-P键数是0.6No
B、2.9g 2CaSO4·H2O含有的结晶水分子数为0.02No
C、100g的98%的浓H2SO4中所含的氧原子数为4No
D、2mol SO2和1 mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2No
8.某化工厂的工业废水中含H2SO4的质量分数为1%,采用边排放边中和的方法将它处理,使之基本呈中性,处理方法如图所示:

若处理后的废水pH=7,则所用NaOH溶液中溶质的质量分数为
A.0.5% B.1% C.2% D.4%
7、右图中a、b、c、d、e、f为元素周期表中前4周期的相邻的一部分元素,下列有关叙述正确的是
A.b、c、e三种元素的单核离子半径大小关系: e>b>c
B.六种元素中,d元素的性质最稳定
C.c的氢化物沸点比f氢化物的沸点低
D.b元素除0价外,只有一种化合价
6、合成NH3的反应N2+3H2 2NH3,起始时的混合气体的平均分子的相对质量为8.5,于一定温度和压强下,反应达到平衡后混合气体的密度比起始时增加了1/4,(设反应前后温度压强不变)则反应中N2的转化率是 ( )
2NH3,起始时的混合气体的平均分子的相对质量为8.5,于一定温度和压强下,反应达到平衡后混合气体的密度比起始时增加了1/4,(设反应前后温度压强不变)则反应中N2的转化率是 ( )
A.20% B.30% C.40% D.50%
|
|
|
|
|
a |
|
|
|
b |
c |
|
|
d |
e |
|
|
|
|
|
|
|
f |
|
5.《科学》评出2004年10大科技突破,其中“火星上‘找’到水的影子”名列第一。下列关于水的说法中错误的是
A.用膜分离的方法可以使海水淡化
B.高效催化剂可使水分解,同时释放能量
C.密度小于1g/cm3的溶液,浓度越大,密度越小
D.金属的电化腐蚀中,水参与了正极反应
4、某同学利用中学化学教材中提供的数据或图表进行如下推理和判断,其中错误的是
A. 依据中和热的数据;推算一定量的H2SO4和NaOH的两种稀溶液反应放出的热量
B. 依据沸点的数据,判断将两种互溶的液态混合物用蒸馏方法分离开来的可能性
C. 依据相对分子质量,一定能判断组成和结构相似的物质熔沸点的高低
D.依据元素的原子结构,可以推知其在元素周期表中的位置
3、室温下,某无色透明溶液中由水电离出来的H+和OH-浓度的乘积为1×10-24,则此溶液中可能大量共存的离子组为
A.HCO3-、Al3+、Na+、SO42- B.I-、NO3-、K+、NH4+
C.MnO4-、Cl-、SO42-、K+ D.SiO32-、SO32-、Na+、Cl-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com