
1.“耐高温长寿命抗氧化陶瓷复合材料应用技术”获2004年度国家技术发明一等奖。该复合材料的强度比钢还大,在航空航天器中用来替代金属材料,可节约20~30%的燃料。下列关于该材料的叙述中不正确的是
A.该材料属于新型无机非金属材料 B.该材料的化学性质非常稳定
C.与金属一样有较好的传热性能 D.可以替代金属做耐高温结构材料
25.(12分)在NO2和O2的混合气体中,NO2所占的体积分数为x。用容积为50mL的容器盛满该混合气体并倒立于水中,足够长的时间后,容器内剩余VmL气体。
⑴试确定x的取值范围与剩余气体体积V的函数关系:V=f(x)。
⑵若最终剩余10mL气体,则原混合气体中NO2的体积分数是多少?
⑶若原50mL混合气体中含有少量N2(小于1mL),请判断在上述条件下,这些N2的存在对第⑵题的计算结果有无影响。
24.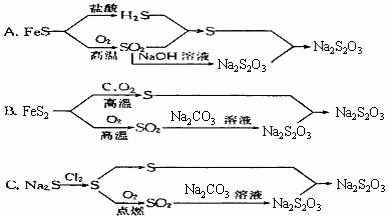 (6分)硫代硫酸钠是一种用途广泛的化工品,某厂技术人员设计了以下生产流程:
(6分)硫代硫酸钠是一种用途广泛的化工品,某厂技术人员设计了以下生产流程:
(1)从中选择最为合理的生产流程,并简要说明理由。
(2)选最合理的生产流程中,若由原料制S的转化率为75%,制SO2的转化率为90%,SO2制Na2SO3的转化率为95%,计算用于制S和Na2SO3的原料的质量比为多少时,才能更多地制得Na2S2O3?(其他消耗不计)
23.(10分)根据碰撞理论,分子在发生反应时必须要进行有效碰撞。那些具有足够高能量,能发生有效碰撞的分子称为活化分子,要使普通分子成为活化分子所需最小能量称为活化能(Ea)。一定温度下气体分子中的活化分子百分数是一定的,而催化剂可以改变活化能的大小。如图表示298.15K时,N2、H2与NH3的平均能量与合成氨反应的活化能的曲线图,据图回答:
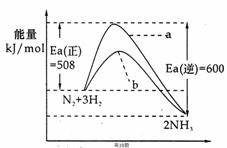
⑴写出合成氨反应的热化学方程 ;
⑵在图中曲线 (填“a”或“b”)表示加入铁触媒的能量变化曲线,铁触媒能加快反应速率的原理 ;
⑶目前合成氨工业广泛采用的反应条件500℃、20~50MPa、铁触媒,反应转化率不超过50%,工业上为了进一步提高氨气产率,你认为下列措施最经济可行的是 ;
A.降低反应温度,让反应向着有利氨气生成的方向进行
B.升高反应温度,让更多的分子变成活化分子
C.寻求能在更低的温度下有很强催化活性的新型催化剂
D.寻求新型耐高压材料,将压强增大一倍
⑷在一定条件下,将3molN2和3molH2充入一个容积固定的密闭容器中发生反应.当反应达到平衡时NH3为n mol.在与上述完全相同的容器中,保持温度不变,若平衡时NH3仍为n mol,则下列组合中正确的是 (填编号)。
|
编号 |
起始状态/mol |
||
|
N2 |
H2 |
NH3 |
|
|
① |
2 |
0 |
2 |
|
② |
2.5 |
1.5 |
1 |
|
③ |
8/3 |
2 |
2/3 |
|
④ |
0 |
0 |
2 |
22.(10分)1919年,Langmuir提出:原子数相同、电子数相同的分子,互称为等电子体。
等电子体的结构相似、物理性质相近,称为等电子原理。后来,该原理被推广使用于一些具有特殊功能的晶体的发现和人工合成等诸多领域。如:X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合该原理。X有如下的转变:
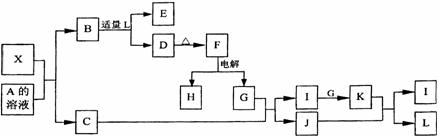
其中:C是无色气体,D为白色沉淀,E溶液的焰色反应中火焰呈黄色。回答以下问题:
(1)写出X的化学式:____ ___,X属于___ ___晶体(填“原子”、“分子”或“离子”)。
(2)写出X与A溶液反应的化学方程式:_______________________________________。
写出常温下H与L反应的离子方程式:_____________________________________。
(3)X与SiC的复合粉末是新一代人规模集成电路的理想散热材料。最近日本科学家研究
 出一种新物质与氮气制备该纳米级复合材料的方法,请将该反应补充完整(方框中填新物质的化学式)。
出一种新物质与氮气制备该纳米级复合材料的方法,请将该反应补充完整(方框中填新物质的化学式)。
+2N2 4X+SiC+3C。
21.(12分)科学家从化肥厂生产的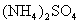 中检出组成为
中检出组成为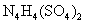 的物质,经测定,该物质易溶于水,在水中以
的物质,经测定,该物质易溶于水,在水中以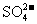 和
和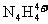 两种离子形式存在,植物的根系极易吸收
两种离子形式存在,植物的根系极易吸收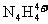 ,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。请回答下列问题:
,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。请回答下列问题:
(1)N4和N2的关系正确的是______________(填序号)
A. 同种单质 B. 同位素 C. 同分异构体 D. 同素异形体
 (2)
(2) ______________(填“能”或“不能”)和草木灰混合施用:
______________(填“能”或“不能”)和草木灰混合施用:
(3)已知白磷、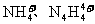 的空间构型均为四面体,
的空间构型均为四面体, 的结构式为:
的结构式为:
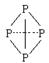 (
( 表示共用电子对由N原子单方面提供),白磷(P4)的结构式为:
表示共用电子对由N原子单方面提供),白磷(P4)的结构式为:
请画出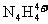 的结构式____________________________;
的结构式____________________________;
(4)已知液氨中存在着平衡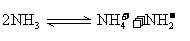 。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的
。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的 生成N4分子,请写出液氨与氢氧化铯反应
生成N4分子,请写出液氨与氢氧化铯反应
的化学方程式:_________________________________ ____________;
(5)含有一定量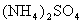 和NH3·H2O的水溶液称为“缓冲溶液”,在此溶液中加入少
和NH3·H2O的水溶液称为“缓冲溶液”,在此溶液中加入少
量的强碱或强酸时,溶液的pH几乎不变,这可由下列离子方程式来说明。
加酸时: 加碱时:
加碱时:
由于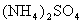 和
和 的大量存在,加少量酸或碱时,溶液中
的大量存在,加少量酸或碱时,溶液中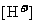 与
与
基本保持不变;
含有一定量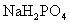 和
和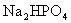 的溶液,也具有缓冲作用,写出此溶液中加入少量
的溶液,也具有缓冲作用,写出此溶液中加入少量
强酸或强碱时发生的离子反应方程式:
加酸时_________________ _______; 加碱时__________________ ________。
20. (6分)锌一锰干电池是普遍使用的化学电池,如图是干电池的基本
(6分)锌一锰干电池是普遍使用的化学电池,如图是干电池的基本
构造图,其中含有MnO2、NH4Cl、ZnCl2等糊状物。
(1)干电池工作时正极上的反应是NH4++e-=NH3+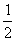 H2,MnO2
H2,MnO2
的作用是除去正极上的产物,本身生成Mn2O3,则锌一锰干电池工作
时电极的总反应化学方程式是____ ___.。
(2)干电池用久了就会变软,其原因是___________ ___。
(3)将1L含有0.4mol CuSO4和0.2mol NaCl的水溶液用惰性电极电解一段时间后,在
一个电极上得到0.2molCu,另一电极上析出气体(在标准状况下)的体积是__ ___升。
19.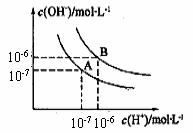 (12分)水是极弱的电解质其可以发生微弱的电离, 纯水
(12分)水是极弱的电解质其可以发生微弱的电离, 纯水
的电离平衡曲线如图所示:
⑴曲线A和B对应的温度不同,其中温度高的为 ,
在B点的纯水的PH= 呈 性
⑵曲线A对应温度下,1 mol/L NaB溶液的pH = 9,则该溶液
中各离子的物质的量浓度由大到小的顺序为 。
⑶曲线B对应温度下,pH = 2的某HA溶液和pH = 10的NaOH溶液等体积混合后,混合溶液的pH =5,结合必要的化学用语解释pH = 5的原因:
。
⑷曲线B对应温度下,若1体积的某强酸和10体积的某强碱混合后溶液显中性,则混合
前强酸的pH(pH酸)和强碱的pH(pH碱)的关系为 。
18.(12分)某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)
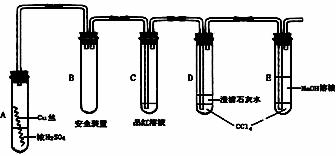
实验选用细铜丝、98.3% H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
|
 以下是该学习小组部分交流记录及后续探究实验的记录,根据上述材料回答下列问题
以下是该学习小组部分交流记录及后续探究实验的记录,根据上述材料回答下列问题
(1)A试管上方的长导管的作用是_______________;D、E两支试管中CCl4的作用是_____________。
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式:__ __。
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是:_____ __。
设计实验验证你的猜想_______ ____。
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是
__ ___。(写化学式)
17.(6分)下列有关化学实验的操作或说法中,正确的是(填写字母代号)
A.过滤、蒸发操作过程中都需要用玻璃棒不断搅拌液体。
B.进行中和热测定实验时,需要测出反应前盐酸与NaOH溶液的各自温度及反应后溶液的最高温度
C.用已知浓度的酸滴定未知浓度的碱时,碱式滴定管用蒸馏水洗后,未用待测液润洗会导致测量的浓度偏低
D.制备硫酸亚铁晶体时,向稀硫酸中加入废铁屑至有少量气泡发生时,过滤,然后加热蒸发滤液即可得到硫酸亚铁晶体
F.测定结晶水时,将灼烧硫酸铜晶体的坩埚放在空气中冷却,然后称量其质量
G.测溶液pH的方法是:取一小片广泛pH试纸置于玻璃片或表面皿上,再用干燥、洁净的玻璃棒蘸取溶液,点在pH试纸中部,然后跟标准比色卡比较
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com