
20. (10分) A-G及X、Y均是中学化学常见物质,其中B、D、E、F、G在常温下为气体且B为红棕色, C的盐溶液通常为蓝色。它们之间有如下转化关系(其中反应③④⑦的产物中还有水):
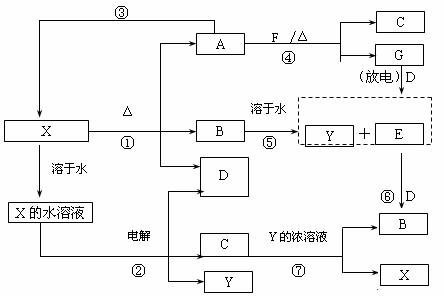
请回答下列问题:
⑴写出G分子的电子式: ;
⑵写出反应⑦的离子方程式是: ;
⑶写出电解X溶液的阳极反应式: ;
⑷写出反应④的化学方程式并标出电子转移情况: ;
⑸若使F按下列途径完全转化为Y:
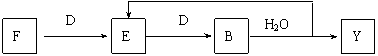
则参加反应的F与整个过程中消耗D的物质的量之比为 。
19.(7分)甲、乙、丙是由短周期元素形成的常见单质,丙在常温下为无色气体,且乙、丙两元素同主族,其余均为常见化合物,它们在一定条件下有如下转化关系(反应中生成的水已略去):
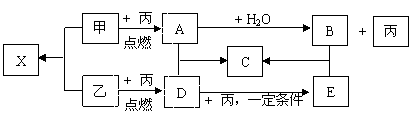
(1)丙的名称是 ;C的化学式是 ;X属于 晶体。
 (2)A+D C的反应属于何种反应类型(填序号) 。
(2)A+D C的反应属于何种反应类型(填序号) 。
A.化合反应 B.氧化还原反应 C.非氧化还原反应 D.离子反应
(3)写出A与H2O反应的化学方程式: 。
(4)若用如右图所示装置来证明A和H2O的反应:
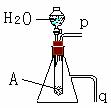 ①是放热反应,②生成了丙。
①是放热反应,②生成了丙。
简单合理的实验操作是:
① ;
② 。
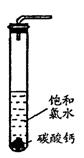
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加。
请回答:

(4)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是
(5)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的CO2气体BL,发现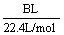 明显小于
明显小于 。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是______
;
。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是______
;
(6)实验后发现,装置Ⅱ中的液体增多了,其原因是_______________ _
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
 ③为了确定反应产物,将滤液分为三份,分别进行以下实验:
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。
请回答:
(1)反应后所得的溶液漂白性增强的原因
(2)写出步骤③中第一份及第三份滤液发生的离子方程式:
第一份:
第三份:
(3)依据上述实验可推知,②的滤液中的溶质除CaCl2、HCIO外,还含有_____ ___;
18.(12分) 饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。2005年的《化学教育》报道了如下实验研究:
17.Ⅰ(4分)下列有关实验或做法中,正确的是(填序号,错选倒扣分)_________________。
A.配制480mL、1.0mol·L-1NaOH溶液时,需称取NaOH固体的质量为20.0g
B.用分液的方法分离苯和水的混合物
C.在同温同压下,等质量的硫在足量的氧气中比在足量的空气中燃烧放出的热量多
D.将mgCO和H2的混合气体完全燃烧后通过过量的Na2O2固体(气体充分反应),固体增重mg
E.排空气法收集一瓶干燥的氨气做喷泉实验,最后液体充满整个容器
F.在实验室制乙烯时.温度计的水银球一定要浸入液面以下并加入碎瓷片防暴沸
G.试纸在使用前需用蒸馏水湿润,然后进行相应试验
Ⅱ(8分)某种胃药片的治酸剂主要成份为碳酸钙,某甲、乙两实验小组的同学测其所含碳酸钙的质量,均有如下操作:
① 配制0.10 mol·L-1 的盐酸和0.10 mol·L-1 的氢氧化钠溶液;
② 将一粒质量为0.2g的此胃药片,磨碎后加入20.00mL蒸馏水;
③ 以酚酞为指示剂,用0.10 mol·L-1 的氢氧化钠溶液滴定,达滴定终点时,消耗体积为V mL;
④ 加入25.00mL0.10mol·L-1 的盐酸溶液。
⑴ 甲组实验过程的步骤为①②④③,乙组实验过程的步骤为①②④③②④③,请根据你的实验经历判断谁更合理。 (填“甲”或“乙”)
⑵下图所示的仪器中配制0.10mol·L-1 盐酸溶液和0.10mol·L-1 氢氧化钠溶液肯定不需要的仪器是(填序号)____ ,配制上述溶液还需要的玻璃仪器是(填仪器名称) 。

⑶配制上述溶液应选用的容量瓶的规格是(填字母)__________________。
①50mL、50mL ②100mL、100mL ③100mL、150mL ④250mL、250mL
16.常温下,0.1 mol·L-1某一元酸(HA)溶液中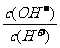 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.该溶液中由水电离出的c(H+)=1×10-11 mol·L-1
B.浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,
则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
C.0.1 mol·L-1HA溶液与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中
c(A-) + c(HA) = c(Na+)
D.0.1 mol·L-1HA溶液与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中
2c(H+)+ c(HA) = c(A-) + 2c(OH-)
第II卷(非选择题,共86分)
15. 500mLKNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6.0mol/L。用石墨作电极电解此溶液,当通电一段时间后,两极都收集到22.4L气体(标准状况),假设电解后溶液的体积仍为500mL。下列说法正确的是:
A.上述电解过程中共转移4mol电子
B.原混合溶液中K+的物质的量浓度为1mol/L
C.电解得到的Cu的物质的量为0.5mol
D.电解后溶液中H+的物质的量浓度为2mol/L
14. 蓄电池在放电时起原电池作用,在充电时起电解池作用,下列是爱迪生蓄电池分别在充电和放电时的反应:Fe +NiO2+2H2O放电充电Fe(OH)2+ Ni(OH)2,下列有关爱迪生蓄电池的推断中不正确的是
A.放电时Fe作负极,NiO2作正极
B.关于标有“-”的接线柱,充电时作阴极,放电时作负极
C.充电时的阳极反应是Fe(OH)2 +2e- == Fe + 2OH-
D.该蓄电池既可用KOH溶液又可用稀H2SO4作电解质溶液
13.已知当物质的量浓度相同时,碳酸中c(CO32-)比偏铝酸中c(AlO2-)大得多,则下列推论中正确的是
A. 通入适量CO2于AlO2-溶液中,有CO32-生成
B. 含CO32-的溶液容易使Al(OH)3溶解变成AlO2-
C. HCO3-只能与Al3+反应而不能和AlO2-反应
D. NH4+、AlO2-和HCO3-能大量共存于同一溶液中
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com