
25.(10分)某研究性学习小组对铝热反应实验展开研究。现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
|
物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
- |
I.⑴某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_________________(填“合理”或“不合理)
⑵设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_______________,反应的离子方程式为_________________________________。
⑶实验室溶解该熔融物,下列试剂中最好的是____________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
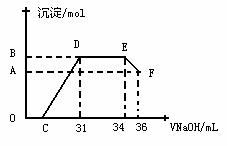 II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
⑴图中OC段没有沉淀生成,此阶段发生反应的离子方程式为_______________________。
⑵在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为_____________;
上述现象说明溶液中_________________结合OH-的能力比_______强(填离子符号)。
⑷B与A的差值为_________mol。
⑷B点对应的沉淀的物质的量为_____mol,C点对应的氢氧化钠溶液的体积为______mL
24. (7分)马来西亚盛产锡器(原料是锡、铜的合金,其中锡的质量分数在95%-98%之间。锡,Sn,位于元素周期表中的第五周期第ⅣA族)。由于其独特的生产工艺,马来西亚生产的锡器不但外形美观,做工精致,而且密封性能非常好,可以长时间保存茶叶、酒等而不至变质。小燕同学今年暑假去马来西亚旅游时带回一些锡制茶叶罐,为了检验这些锡器的真伪,小燕同学进行了如下实验:
⑴在锡器上刮取少量锡,用分析天平称得质量为0.589g;
⑵将0.589g锡全部溶于稀盐酸;
⑶向⑵中所得溶液加入过量的FeCl3溶液;
⑷最后用已知浓度的K2Cr2O7溶液滴定⑶中生成的Fe2+。
问题I:写出第⑵、⑶步中化学反应的离子方程式: 第⑵步 ;第⑶步 ;
问题II:第⑷步中K2Cr2O7物质的量浓度为0.100mol·L-1,用去K2Cr2O7溶液的体积为16.00mL。小燕所购回的锡器是真的吗?(如有需要,可参考本试卷中的有关信息)
23.(10分)2005年全世界石油价格居高不下,其主要原因是随着社会生产的发展\人口增多,对能源的需求量逐年增加,全球石油储量下降。寻求和制备代号称“黑金”的新能源已经成为紧迫任务,化学工作者正在研究以天然气和醇类合成优质汽油的方法。
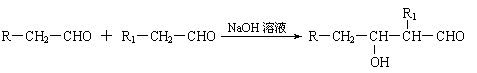 已知:⑴凡与醛基直接相连的碳原子上的氢称为α一H原子,在稀碱溶液的催化作用下,一个醛分子上的α一H原子连接到另一个醛分子的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:
已知:⑴凡与醛基直接相连的碳原子上的氢称为α一H原子,在稀碱溶液的催化作用下,一个醛分子上的α一H原子连接到另一个醛分子的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:
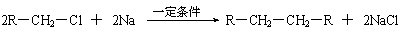
⑵
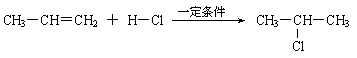
⑶
合成路线如下:
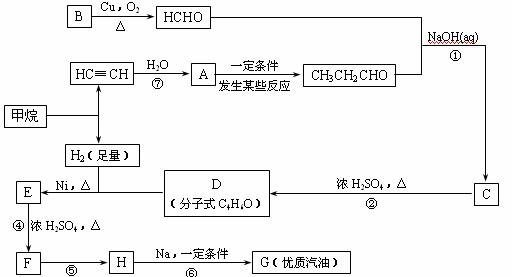
⑴在反应②-⑦中,属于加成反应的是 ,属于消去反应的是 。
⑵写出下列反应方程式
E → F: ;
H → G: 。
⑶H也能与NaOH溶液反应,其反应方程式为 ,
生成的有机物能否在Cu或Ag作催化剂的条件下被空气氧化 (选填“能”或“否”)。
22.(8分)某烃A的相对分子质量为140,其中碳的质量分数为0.857。A分子中有两个碳原子不与氢直接相连。A在-定条件下氧化只生成C,C能使石蕊试液变红。已知:
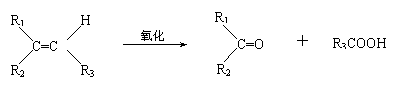
试写出:
⑴A的分子式 。
⑵化合物A和C的结构简式:A ;C 。
⑶与C同类的同分异构体(含C)有 种。
21.(8分) 下图为某些常见物质之间的转化关系。已知:A、B、I中含有相同的阳离子且都是XY2型化合物,I是常用的干燥剂,C为直线型分子。
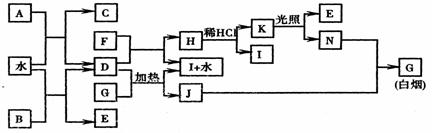
请按要求填空:
(1)B的电子式是 ,K的结构式是 ;
(2)D与G反应的化学方程式是 ;
(3)单质F与D的反应在工业上有重要的用途,其化学方程式是
。
20. (9分)某试剂厂有银(含杂质铜)和硝酸(含杂质Fe3+)反应制取硝酸银.步骤如下
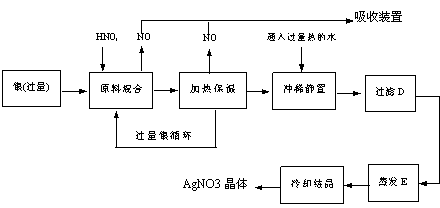
依据上述步骤,完成下列填空:
(1)溶解银的硝酸应该用 硝酸(填浓或稀)。原因是 (填序号,下同)
(a)减少过程中产生NOX的量 (b)减少原料银的消耗量 (c)节省硝酸物质的量
(2)步骤B加热保温的作用是 .
(a)有利于加快反应速率
(b)有利于未反应的硝酸挥发
(c)有利于硝酸充分反应,降低溶液中[H+]
(3)步骤C中是为了除去Fe3+、Cu2+等杂质,冲稀静置时发生的化学反应是
(a)置换反应 (b)水解反应 (c)氧化还原反应
产生的沉淀物化学式 .
19.(12分)硼酸晶体呈片状,有滑腻感,可作润滑剂,硼酸对人体的受伤组织有缓和和防腐作用,故可以用于医药和食品防腐等方面。试回答下列问题:
⑴从题目信息可知硼酸应属于 酸(填强、中强、弱);
⑵硼酸的分子式为H3BO3,已知H与O成键,则其分子结构式为: ;
⑶研究表明:在大多数情况下,元素的原子在形成分子或离子时,其最外层具有达到8电子稳定结构的趋向。已知0.01mol硼酸可以被20mL 0.5mol·L -1NaOH溶液恰好完全中和,据此推测硼酸在水溶液中呈酸性的原因是(用离子方程式表示、酸根离子
用结构式表示) ;
写出硼酸与NaOH溶液反应的化学方程式: ;
⑷硼酸和甲醇在浓硫酸存在的条件下,可生成挥发性硼酸酯,试写出硼酸完全酯化的
方程式: ;
⑸科学家发现硼化镁在39 K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列,右图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。
根据右图确定硼化镁的化学式为 。

18.(14分) I.课本中介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
⑴实验室可用化学方法替代“闻生成物的气味”,写出该化学方法的化学反应方程式
。
⑵某同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确?
。
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。请填写下列空白:
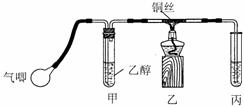
⑴乙醇发生催化氧化的化学反应方程式为 。
⑵实验时,常常将甲装置浸在70℃-80℃的水浴中,目的是 ____;由于装置设计上的缺陷,实验进行时可能会 ____________
⑶反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。
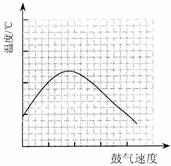
试解释鼓气速度过快,反应体系温度反而下降的原因: ;
你认为该实验中“鼓气速度”这一变量可用 来计量___________。
17. (8分) ①实验室可利用下图1所示装置来制取气体 (写出两种常见气体的化学式);②已知草酸(乙二酸)在受热时发生如下分解反应:H2C2O4 CO+CO2+H2O 。某同学拟用图1的改进装置图2来验证上述反应中有CO2和H2O生成。已知:草酸晶体的化学式为:H2C2O4·2H2O,熔点为100.1℃,分解温度约为170℃-180℃。试结合所学知识,分析该实验设计中的不足之处(至少指出3处)
。
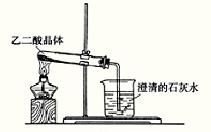
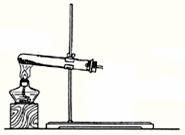
图1 图2
16. 某硝酸盐受热分解的产物为金属氧化物和NO2、O2。下列相关叙述正确的是
A.分解产生的气体能使余烬木条复燃,证明其中含有氧气
B.若分解的固体产物全为CuO,则产生的混合气体从理论上说可恰好完全溶解于水
C.若产生NO2和O2的物质的量之比为6:1,则金属元素在分解过程中化合价降低
D.若3.76g Cu(NO3) 2无水晶体受热分解,得到1.52g固体,则固体中有Cu2O 0.72g
第Ⅱ卷(非选择题 共86分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com