
2.下列实验操作中,合理的是
A.实验室制乙烯时,在酒精和浓硫酸的混合液中,放入几片碎瓷片,加热混合物,使液体温度迅速升到170℃
B.实验室进行酯化反应实验时,在试管中将3mL乙醇和2mL冰醋酸依次加入到2mL浓硫酸中,再加入碎瓷片,用酒精灯加热,用饱和碳酸钠溶液吸收蒸出物
C.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置,待液体分层后,滴加硝酸银溶液
D.验证蔗糖水解产物时,在蔗糖溶液中加入几滴稀硫酸,水浴5min,加入新制银氨溶液
1.韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成“暖
冰”。下列关于“暖冰”的说法不正确的是
A.“暖冰”也是水分子间通过氢键结合而成的固体
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.形成20℃时的“暖冰”的变化是物理变化
D.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
[xxv]、下列实验中的其它实验操作均正确,但由于存在的某些错误操作而导致所得到的实际数据一定偏高的是___________。
A.用托盘天平称量m g氢氧化钠固体时,将氢氧化钠固体逐渐加入到置于托盘天平右盘上的烧杯中,砝码放在左盘,所取用氢氧化钠固体的实际质量。
B.测定硫酸铜晶体结晶水含量时,加热温度太高,使一部分硫酸铜发生分解,所得到的结晶水的含量。
C.测定硝酸钾溶解度时,蒸发结晶硝酸钾晶体的过程中有液滴溅出,所得到的硝酸钾溶解度。
D.配制一定物质的量浓度的氯化钠溶液,容量瓶中残留有少量蒸馏水,所得到的氯化钠溶液的物质的量浓度。
E.用量筒量取10mL的稀硫酸时,用仰视读数的方式量取,所得到的稀硫酸的实际体积。
[xxvi]、某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如右图。该实验的主要操作步骤如下:
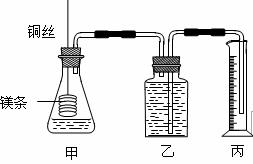
①配制浓度均为1 mol·L-1盐酸和醋酸溶液;
②用 量取10.00 mL1 mol·L-1盐酸和醋酸溶液分别加入两个锥形瓶中;
③用精确的天平分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为 ;
④在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录
;
⑥反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应 ,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题:
⑴用文字表述④检查该装置气密性的操作与观察方法:
。
⑵本实验中应选用 (填序号)的量筒。 A.100 mL B.200 mL C.500 mL
⑶若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为Vm= 。
⑷简述速率不等的原因 ,铜丝不与酸接触的原因是 。
[xxvii]、现有aA、bB、cC、dD、eE五种短周期元素,它们都是生命体不可缺少的重要元素。已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e,B、D、E都有多种同素异形体。人类已知的化合物中,有一类化合物的种类已超过三千万种,这类化合物中一般都含有A、B两种元素。根据以上信息回答下列有关问题:
(1)请写出下列元素的元素符号:
B________________ D______________ E_______________。
(2)写出B、D两元素组成的非极性分子的电子式_____________________。
(3)写出由上述五种元素中的四种元素组成的离子化合物的化学式(写出2种即可)
_____________________、________________________。
(4)在A、B、D三种元素中选择2种或3种元素,组成2种可发生反应的阴离子,请写出该反应的离子方程式:___________________________________________。
[xxviii]、X、Y、W是中学化学中常见的无机物,且各由两种元素组成;甲、乙、丙是三种常见的单质;这些化合物和单质间存在如下图所示转化关系(这些转化关系都不需要使用催化剂)。回答下列问题
X、Y、W是中学化学中常见的无机物,且各由两种元素组成;甲、乙、丙是三种常见的单质;这些化合物和单质间存在如下图所示转化关系(这些转化关系都不需要使用催化剂)。回答下列问题
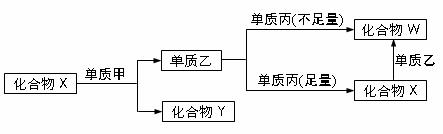
(1)若甲为常见的金属单质,乙为黑色的非金属固态单质,且甲、乙、丙均由短周期元素组成。则化合物X与单质甲的化学反应方程式是_____________________。化合物X与单质乙的反应方程式____________________________
(2)若丙是常见过渡元素的金属单质,乙在常温下为液态非金属单质。甲与乙同主族,且此过程中的反应都在溶液中进行。则:
①写出化合物W与单质丙反应的离子方程式________________________。
②若化合物X与单质甲以物质的量之比为1.25:1进行充分反应,则该反应的离子方程式为____________________________________。
[xxix]、两种非金属元素X、Y在元素周期表中彼此相隔一个周期,它们的单质Xm、Yn和水在一定条件下能发生反应:Xm+Yn+H2O→HY+H3YO4+XH4Y(未配平)。(m、n均为大于1的正整数)
(1)若Xm、Yn在常温下均为常见固体,则Xm是 ,Yn是 ;
(2)试根据推断后,完成(配平)上述化学方程式
;
(3)试解释下列两反应能进行的原因:
①HY(aq)+NaH2XO4(aq)=H3XO4(aq)+NaY(aq),理由是 ;
②H3XO4(浓)+NaY(固)=HY+NaH2XO4,理由是
。
[xxx]、将4.42g复盐CuSO4·x(NH4)2SO4·yH2O加到过量NaOH溶液中,加热,生成的气体用100mL 1mol·L-1 H2SO4吸收,多余的H2SO4用80mL 2mol·L-1 NaOH恰好完全中和,另取等质量的复盐溶于水后与足量BaCl2溶液反应,生成6.99g沉淀,求x、y的值。
[xxxi]、某化肥厂生产硝酸铵过程如下:
|
|
|
|

|


|
其中反应②为:4NO+3O2+2H2O===4HNO3,原料气为氨气和空气的混合物,假设空气中氧气的体积分数为0.2。
(1)写出反应①的化学方程式_____________________________________。
(2)若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中制备硝酸的氨气(不包含第③步被硝酸吸收的氨气)的体积分数最大值为_____________。
(3)若实际生产中,反应①、②、③的转化率(或利用率)分别为a、b、c,则生产硝酸的氨气占所用氨气总量的体积分数为多少?在合成硝酸铵的全流程中,氨气的总利用率为多少?(请写出该小题的计算过程)
-
[i]、化学家庭小实验是利用家庭日常用品进行化学学习和探究的活动,下列实验能利用家庭日常用品进行的实验是
①证明马铃薯中含有淀粉 ②除去热水瓶中的水垢
③检验自来水是否是硬水(主要是由钙、镁离子引起) ④淀粉溶液具有丁达尔现象
A、①②③④ B、①③④ C、①②③ D、①②④
[ii]、若实行海水淡化供应饮用水,下列方法在原理上完全不可行的是
A、己明矾使海水中的盐份沉淀而淡化
B、利用太阳能使海水蒸馏而淡化
C、将海水缓慢凝固以获取淡化的饮用水
D、将海水通过离子交换树脂,以除去所含盐份的离子
[iii]、某溶液中含有NO3-、SiO32-、AlO2-、S2-等4种离子,若向其中先加入过量盐酸溶液,微热搅拌,再加入过量NaOH溶液,则溶液中大量减少的阴离子是
A、NO3-、S2- B、SiO32-、AlO2- C、NO3-、AlO2- D、SiO32-、S2-
[iv]、1999年英国科学家L. Taom博士合成和分离出了含高能量的N5+离子的化合物N5AsF6。下列有关叙述不正确的是
A.N5+离子中氮氮原子之间以共价键相结合
B.AsF6-离子中As与F之间的化学键为离子键
C.1 mol N5+ 离子共有34×6.02×1023个核外电子
D.在化合物N5AsF6中,氟元素呈―1价
[v]、下列叙述正确的是
A.化合反应一定不是氧化还原反应
B.红磷与白磷互为同素异形体
C.植物吸收氮肥的过程称为生物固氮
D.强电解质溶液的导电性一定比弱电解质溶液强
[vi]、常温下用石墨电极,电解100 mL 0.1 mol·L-1 Cu(NO3)2和0.1 mol·L-1 AgNO3组成的混合溶液,当某一电极上生成的气体在标准状况下体积为0.112 L时,假设溶液体积不变,下列说法正确的是
A.阴极增重1.4 g B.所得溶液 pH=1
C.阴极增重0.64 g D.所得溶液pH>1
[vii]、美国《科学》杂志评出了2001年十大科技成就,名列榜首的是纳米电子学,其中美国的IBM公司科学家制造了第一批纳米管晶体管,发明了利用电子的波性来传递信息的“导线”。已知纳米材料是指微粒直径在1~100nm的材料。下列叙述正确的是
A.纳米碳管是一种新型的高分子化合物 B.纳米碳管的化学性质稳定
C.纳米碳管导电属于化学变化 D.纳米碳管的结构和性质与金刚石相同
[viii]、00C,1.01×105Pa下,下列混合气体的平均式量有可能为40的是
A、H2、O2 B、H2S、SO2 C、SO2、HBr D、Cl2、HI
[ix]、下列实验中,合理的是
A、用25mL碱式滴定管量取18.40mLNaOH溶液
B、用100mL量筒量取5.20mL盐酸
C、用托盘天平称取25.20gNaCl
D、用pH试纸测得某溶液pH=3.23
[x]、足量MnO2与VmL10mol/L盐酸共热制氯气,标准状况下产生2.24L Cl2,则V的取值应为
A、V=20 B、V>40 C、V=40 D、20<V<40
[xi]、碘是原子 较大的卤族元素,可能呈现金属性,下列事实能说明这个结论的是
A、已经制得IBr、ICl等卤素互化物
B、已经制得I2O5等碘的氧化物
C、已经制得I(NO3)3、I(ClO4)3等化合物
D、I2通常情况下是固体
[xii]、气体X可能含有Cl2、HBr、CO2中的一种或几种,已知X通人AgNO3溶液时产生淡黄色沉淀,且沉淀不溶于稀硝酸;再将X通人澄清石灰水,无沉淀产生,则关于气体X的成分,下列说法中正确的是
A、一定有HBr,可能有CO2 B、一定无Cl2、CO2
C、可能有Cl2、CO2 D、一定有HBr、CO2
[xiii]、X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z原子的最外层电子数是内层电子数的3倍。有关下列叙述正确的是
A、X肯定为碱金属元素
B、X、Y两元素形成的化合物可能为离子晶体
C、稳定性:X的氢化物>Z的氢化物
D、Y、Z两元素形成的化合物熔点很高
[xiv]、在1mol赤热的Cu2S最通入足量的水蒸气,生成2mol H2,则Cu2S转化为
A、Cu和SO2 B、Cu和S C、CuO和SO2 D、Cu2O和S
[xv]、可逆反应:3A(g)
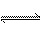 3B(?)+C(?);△H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是 ①B和C可能都是固体 ②B和C一定都是气体
③若C为固体,则B一定是气体 ④B和C可能都是气体
3B(?)+C(?);△H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是 ①B和C可能都是固体 ②B和C一定都是气体
③若C为固体,则B一定是气体 ④B和C可能都是气体
A、 ①④ B、①③④ C、② D、③④
[xvi]、根据某些性质,NaOH(s)、P2O5(s)、CaCl2(s)可以归为一类。据此,与这些物质可归为一类的程度最接近的物质是
A、浓硫酸 B、NaCl C、碱石灰 D、氧化钙
[xvii]、标准状况下,将CO2和CO的混合气体(ρ=10/7 g/L)充满一盛满足量的Na2O2的密闭容器中(容积为22.4L),用间断电火花引发反应充分燃烧,反应后对容器中存在的物质叙述正确的是
A、0.5mol CO B、0.125molO2 C、0.25mol Na2CO3 D、0.5molNa2CO3
[xviii]、0.03mol Cu完全溶于硝酸,产生氮的氧化物(NO2、NO、N2O4)混合气体共0.05mol。则该混合气体的平均相对分子质量可能是
①34 ② 38 ③45 ④48 ⑤50 ⑥66
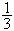 A、①②③ B、②③④ C、③④⑤ D、④⑤⑥
A、①②③ B、②③④ C、③④⑤ D、④⑤⑥
[xix]、25℃时,将pH=x的H2SO4溶液与pH=y的NaOH溶液按体积比1:100混合,反应后所得溶液pH=7。若x= 1/3 y,则x值为
A.2 B.3 C.4 D.5
[xx]、近年来,加“碘”食盐较多的使用了碘酸钾(KIO3), 碘酸钾以工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:
KI+3H2O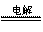 KIO3+3H2↑。下列有关说法不正确的是(碘酸是强酸)
KIO3+3H2↑。下列有关说法不正确的是(碘酸是强酸)
A.电解时,石墨作阴极,不锈钢作阳极
B.电解时,阳极反应是:I--6e- +3H2O=IO3-+6H+
C.当电解过程中转移3mol e-时,理论上可制得KIO3 107g
D.电解前后溶液的pH几乎不变
[xxi]、MCFC型燃料电池可同时供应电和水蒸气,其工作温度为600℃-700℃,所用燃料为H2,电解质为熔融的K2CO3,已知该电池的总反应为2H2+O2=2H2O(该电池放电过程中,CO2被循环利用)。则下列有关该电池的说法正确的是
A、该电池的正极的反应式为:4OH-+4e-====O2+2H2O
B、该电池负极的反应为:H2+CO32--2e-====H2O+CO2
C、当电路中通过a mol电子时,则该电池理论上可供应18a g水蒸气
D、放电时CO32-向正极移动
[xxii]、用一定量的铁与足量的稀硫酸及足量的CuO制单质铜,有人设计了以下两种方案:
若按实验原则进行操作,则两者制得单质铜的量为
A.一样多 B.①多 C.②多 D.无法判断
[xxiii]、对于平衡体系:mA(g)+nB(g)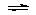 pC(g)+qD(g)(正反应放热),有下列判断,其中正确的是
pC(g)+qD(g)(正反应放热),有下列判断,其中正确的是
A.若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.58倍,则m+n<p+q
B.若反应从正反应开始,达平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m : n
C. 若平衡体系中共有气体amol,再向其中加入bmolB,当重新达到平衡时,气体的总物质的量等于(a+b),则m+n≠p+q
D.若m+n=p+q,则当容器内温度升高时,平衡逆向移动,但容器中气体的压强不变。
[xxiv]、从植物花中可提取一种简写为HIn的有机物,它在水溶液中因存在下列平衡:
HIn(溶液,红色)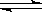 H+(溶液)+In-(溶液,黄色) 而用作酸碱指示剂。往该溶液中加入Na2O2粉末,则溶液颜色为
H+(溶液)+In-(溶液,黄色) 而用作酸碱指示剂。往该溶液中加入Na2O2粉末,则溶液颜色为
A.红色变深 B、黄色变浅 C、黄色变深 D、褪为无色
26.(8分)2005年国家质检总局铝合金抽检合格率约为90%。已知国家行业标准中铸造铝合金的各成分的质量分数为:Si-4.5%-5.5%,Cu-1.0%-1.5%,Mg-0.4%-0.6%,其余为Al。
现对某品牌的铸造铝合金中所含的四种成分作如下的实验检测:
①称取18.0g铸造铝合金样品,分成等质量的A、B两份。向A份加入足量NaOH溶液,B份加入足量的稀盐酸。(已知:Si+2NaOH+H2O=Na2SiO3+2H2↑)
②待两份反应物都充分反应之后,称得滤渣质量相差0.512 g,收集得到的两份气体的体积相差851.2 mL(标准状况下)。试回答下列问题:
(1)样品中Si和Mg的物质的量分别是多少;
(2)通过计算判断该品牌的铸造铝合金是否为合格产品。
25.(10分)材料M由X、Y两种元素组成,已知M的化学组成为XY8,X为碱金属元素。为进一步确定其成分,先取一定量的M在足量的纯氧中充分灼烧,产生了无色略带酸味的气体A和过氧化物B(此条件下不考虑A与B反应),且A能使澄清石灰水变浑浊。另取1.17 g B加入水中能完全溶解,再将其定容为500 mL,取出25.00 mL加入锥形瓶中,用0.1150 mol·L-1盐酸滴定,当滴入10.00 mL盐酸时,经测定溶液的pH=12。
(1)通过计算和推理确定组成:A是_______(填化学式,下同),B是_________,M是__________。
(2)若取x g M(甲、乙两种元素化合价均为0),加热使其完全溶于浓硝酸,假定浓硝酸还原产物只有NO和NO2且两者的物质的量相同,试通过计算求出反应中消耗硝酸的物质的量y与材料M的质量x的函数关系表达式。
24.(10分)A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如右(图中部分产物未列出):
请填写下列空白:
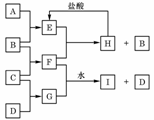
(1)A是________,C是________。
(2)H与盐酸反应生成E的化学方程式是_____________。
(3)E与F反应的化学方程式是_______________________。
(4)F与G的水溶液反应生成I和D的离子方程式是________。
23.(14分)以下各物质均为中学阶段常见的化合物,它们的相互转化关系如下图所示:
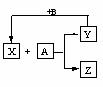
(1)若在通常情况下能发生如图所示转变关系,且常温下X为气态,A为非气态,则符合关系的有:(请填写化学式,下同。)
|
X |
|
|
A |
|
(2)若X+A→Y+Z在常温下能进行,Y→X在一定条件下进行,且A、Y为单质,则符合关系的有:
|
|
第一种情况 |
第二种情况 |
|
X |
|
|
|
A |
|
|
(3)若X+A→Y+Z,Y→X均在一定条件下进行,且A、Y为单质,则符合关系的有:(请填写化学式,可以不填满,也可以补充)
|
|
第一种情况 |
第二种情况 |
第三种情况 |
第四种情况 |
|
|
X |
|
|
|
|
|
|
A |
|
|
|
|
|
22.(11分)化合物M是白色晶体,不溶于水,微溶于乙醚,丙酮,溶于氯仿,苯等中,用做乙烯聚合的催化剂。化合物M中含有19.06%的X元素。将10.00g的M在足量氧气中燃烧,得到标准状况下2.75 g固体氧化物,14.11 L CO2气体和4.73 g液态水。X的单质是灰白色金属,具有类似金刚石的结构,不溶于水及非氧化性酸、碱、溶于王水、硝酸、浓热的硫酸,X在地壳中的含量为7×10-4%,主要用做半导体材料。
(1)X的元素符号是_______,在周期表中位于_______周期第_______族。
(2)X与比它大20号的元素形成的化合物______(填化学式)是有效的化合物半导体。
(3)X能被含有过氧化氢的碱侵蚀,写出反应方程式__________________________。
(4)在四氯化碳中M与溴反应,生成的化合物中含20.82%的Br。
①写出反应方程式:___________;
②选用四氯化碳为溶剂的理由是___________________________________。.
21.(8分)某同学设计了如图所示测定红磷在氯气中燃烧产物的分子式的装置,该装置中B是底面积为100 cm2的圆筒状玻璃容器(密封盖上装有阀门),上面标有厘米单位的刻度,其它夹持装置已略去。操作步骤:
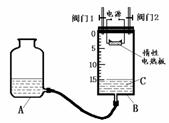
①检查装置的气密性;②将0.5 g 红磷平铺在电热板上,盖紧容器;③打开阀门1、阀门2,从A的瓶口加入液体C,使B中液面至刻度15.0 cm;④向B中充入氯气,待氯气充满后关闭阀门1、阀门2,通电加热红磷。……请回答下列问题:
(ⅰ)检查装置气密性具体方法是_____________________________。
(ⅱ)实验步骤③加入的液体C是__________________(填名称)。
(ⅲ)反应结束并充分冷却后,读取B中液面刻度读数时,应注意__________________;若液面在刻度5.6 cm处,此时实验条件近似看作标准状况,则生成物PClx中x的值是______________(计算结果保留1位小数)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com