
20.课本上讲对于一定条件下的可逆反应,无论从正反应开始,还是从逆反应开始,都可以达到相同的平衡状态。一定温度下,碳与水蒸气在密闭容器中发生反应并建立化学平衡C(s)+H2O(g) CO(g)+H2(g);△H>0
CO(g)+H2(g);△H>0
⑴平衡混合气体的平均相对分子质量M1的取值范围为 > M1> 。
⑵若使用CO和H2从逆反应方向在相同条件下建立平衡,则平衡混合气体的平均相对分子质量M2的取值范围为 > M2> 。此时若加压,平衡向 (填“左”、“右”或“不”)移动。设原平衡混合气中气体的物质的量共a mol,加压重新达到平衡时混合气比原平衡减少b mol,则新平衡时,混合气平均相对分子质量M3与M2的关系为M3= (用M2、a、b的数学式表示)。
⑶在⑵建立的平衡中,当①M3=M2时,M2= ,此时反应开始时所用CO和H2的物质的量之比为 ;②当M2< 时,M3<M2;当M2> 时,M3>M2。
⑷由⑶得到结论:从逆反应方向建立平衡时,M3与M2的相对大小主要取决于 。
19.A-J是中学化学中常见的几种物质,它们之间的转化关系如下图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,相同质量的E固态时比液态时体积大,J可作禽流感、SARS等病毒的杀菌消毒剂。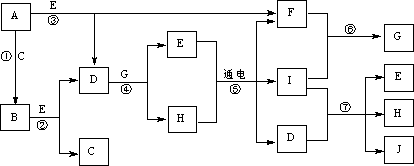
⑴B的电子式为:_________________。E固态时比液态时体积大的原因是
。
⑵反应②的离子方程式: 。
反应⑦的离子方程式: 。
⑶以Pt为阳极、铁为阴极电解滴加有少量酚酞的H饱和溶液,则阳极的电极反应式
为:__________________。阴极附近的现象为 。
18.为了在实验室模拟用二氧化氮溶于水生成硝酸,现进行如下实验:
实验一:制备并收集一试管二氧化氮
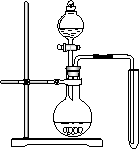 ⑴实验室常用浓硝酸与铜反应制备二氧化氮,化学方程式
⑴实验室常用浓硝酸与铜反应制备二氧化氮,化学方程式
是
⑵可用右图装置制备并收集一试管二氧化氮,
①在加入药品前,必须进行的操作是
。
②该装置的缺点是(只填一个缺点既可)
 。
。
实验二:尽可能多地使试管中的二氧化氮被水吸收
⑶将装有二氧化氮的试管A倒插入水中(图Ⅱ),并轻轻晃
动试管,观察到的现象是:
。
⑷从下图中挑选所需的仪器,完成制取O2,并将O2通入到上述实验后的试管A中。
①画出制取O2装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置不用画),并标明所用试剂。

②某同学在试管A内通入O2的过程中没有观察到液面上升,而是试管内充满了无色气体,可能原因是 。
17.⑴ 下列实验操作或对实验事实的描述不正确的是 (填序号)
① 已烷中混有已烯,加入足量的溴水,充分振荡,静置分层后分离
② 配置硫酸铜溶液时应向溶液中加入少量的铜粉
③ 实验室可以用双氧水和二氧化锰制取少量的氧气
④ 向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
⑤ 向某溶液中先通入Cl2再滴加KSCN溶液时溶液变红,证明该溶液一定含有Fe2+
⑥ 将Fe(NO3)2溶液加热蒸发至干并灼烧,最后得到红棕色粉末
⑦ 分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多
⑧在试管中放入几片碎滤纸,滴几滴90%的浓硫酸,再将滤纸捣成糊状,微热并冷却后先滴入几滴CuSO4溶液再加入过量的NaOH溶液加热至沸腾,可观察到红色沉淀生成
⑵ 某校化学兴趣小组学生进行如下实验。
a、使用铜和稀硫酸制备硫酸铜晶体。步骤如下:

步骤①观察到的现象是: ___________________________ 。
步骤③的主要操作包括:_________________________________ 。
b、某同学查询资料得知:铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2,铜屑可逐渐溶解,该反应的化学方程式是: 。
16.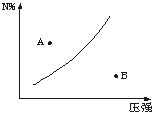 可逆反应:mM(s)+nN(g)
可逆反应:mM(s)+nN(g) pQ(g);ΔH<0,在一定温度下N%与压强的关系如下图,下列有关叙述正确的是
pQ(g);ΔH<0,在一定温度下N%与压强的关系如下图,下列有关叙述正确的是
A.A点时混合物的v(正)>v(逆)
B.A点比B点反应速率快
C.n>p
D.m+n>p
第Ⅱ卷(共86分)
15.常温下,将等质量下列物质:①CaO、②NaOH、③Na2O、④Na2O2,分别投入到一定量水中充分反应,所得溶液的质量分数排列顺序可能正确的是
A.①>③=④>② B.①>③>④>②
C.④>①>③>② D.③>④>②>①
14.下列各组离子在相应的条件下一定能大量共存的是
A.在中性溶液中:AlO2-、Br-、K+ 、Al3+
B.与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+、Na+、SO42-
C.在c(H+)/c(OH-)=1×1013的溶液中:NH4+、Ca2+、C1-、K+
D.在含有S2-离子,且滴加酚酞显红色的溶液中:Na+、K+、ClO-、Cl-
13.将6 mol A和5 mol B两气体通入容积为4 L的密闭容器,一定条件下反应:
3A(g)+B(g) 2C(g)+xD(g);ΔH<0,经5 min达平衡,此时生成2 mol C,测得D的平均反应速率为0.1
mol·(L·min)-1,下列说法正确的是
2C(g)+xD(g);ΔH<0,经5 min达平衡,此时生成2 mol C,测得D的平均反应速率为0.1
mol·(L·min)-1,下列说法正确的是
A.若降低该平衡体系的温度,则逆反应速率减小,正反应速率增大,平衡正向移动
B.恒温下,当容器中C和D的生成速率达到相等时,该反应达到平衡状态
C.A的平均反应速率为0.15 mol·(L·min)-1
D.达平衡时B的转化率为25%
12.某金属氧化物在光照下可生成具有很强氧化能力的物质,能用来消除空气或水体中的污染物。下列有关该金属氧化物的应用的叙述不正确的是
A.将形成酸雨的SO2氧化为SO3
B.将家居装修挥发出的甲醛氧化为CO2和H2O
C.将医药废水中的苯酚氧化成H2O和CO2
D.将汽车尾气中的CO和NO分别氧化成CO2和N2
11.设阿伏加德罗常数的数值为NA,下列有关说法正确的是
A.常温常压下,20g重水中所含质子数为10NA
B.在12 g金刚石中,含共价键4NA
C.标准状况下,0.5NA个CCl4所占的体积约为11.2L
D.42gNaHCO3固体含有的离子数为NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com