
[xxii].在两支试管中分别加入3mL 2mol·L-1的稀盐酸,将两个各装有0.3gNaHCO3和0.3g Na2CO3粉末的小气球分别套在试管口。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到的现象如下:
(1) 试管中(填产生沉淀或气体及反应速率等相关现象)_____________________________
________________________________________________________________________。
(2) 盛______的试管中气球变得更大,大小气球体积之比约为_______(填最简单整数比)。
(3) 甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有所升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。类似如中和热,甲同学写出了下列热化学方程式:
HCO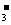 (aq)+H+(aq)=H2O(l)+CO2(g);ΔH>0
(aq)+H+(aq)=H2O(l)+CO2(g);ΔH>0
CO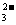 (aq)+2H+(aq)=H2O(l)+CO2(g);ΔH<0
(aq)+2H+(aq)=H2O(l)+CO2(g);ΔH<0
甲同学下结论的方法是否正确 (填“正确”或“不正确”)。
(4) 为研究上述反应是吸热还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
|
序号 |
试剂1 |
试剂2 |
混合前温度 |
混合后最高或最低温度 |
|
① |
35mL水 |
2.5g NaHCO3固体 |
20℃ |
18.5℃ |
|
② |
35mL水 |
3.2 Na2CO3固体 |
20℃ |
24.3℃ |
|
③ |
35mL稀盐酸 |
含2.5g NaHCO3的饱和溶液32.5mL |
20℃ |
19℃ |
|
④ |
35mL稀盐酸 |
含3.2g Na2CO3的饱和溶液23.1mL +10ml水 |
20℃ |
24.2℃ |
|
⑤ |
35mL稀盐酸 |
2.5gNaHCO3固体 |
20℃ |
16.2℃ |
|
⑥ |
35mL稀盐酸 |
3.2g Na2CO3固体 |
20℃ |
25.1℃ |
请你帮助填写相关内容:
该研究报告的题目是《____________________________________________________》;
该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为______________和______________;
通过上述实验可得出五条结论:
a:NaHCO3的溶解是__________(填“吸热”或“放热”,下同)过程;
b:Na2CO3的溶解是__________过程;
c:NaHCO3的饱和溶液和盐酸的反应是__________反应;
d:Na2CO3的饱和溶液和盐酸的反应是__________反应;
e:NaHCO3固体与稀盐酸反应的反应热是由_________(填a~d的字母)的热效应之和。
[xix].(14分)
(1) 下图是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为
“doggycene”。

①doggycene的分子式为________________;
②1mol该物质在氧气中完全燃烧生成CO2和水的物质的量之比为__________;
③该分子中所有碳原子__________(填“可能”或“不可能”)处于同一平面。
(2) 苹果醋(ACV)是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效,主要酸性物质为苹果酸。苹果酸在分离提纯后的化学分析如下:①相对分子质量不超过250,完全燃烧后只生成CO2和H2O,分子中C、H质量分数分别为w(C)=35.82%、w(H)=4.48%;②0.1 mol该酸与足量的NaHCO3反应放出4.48 L CO2,与足量的Na反应放出3.36 L H2(气体体积均已折算为标准状况);③该分子中存在四种化学环境不同的碳原子,氢原子也处于四种不同的化学环境。
回答下列问题:
①苹果酸的分子式为____________,分子中有________个羧基。
②写出苹果酸的结构简式____________________________。
③苹果酸的同分异构体中,符合上述①、②两个条件的有(写出结构简式):
_______________________________________________________________________
[xx].(8分) A、B、C、D、E、F、G、H八种短周期元素,其单质的沸点如下图所示。
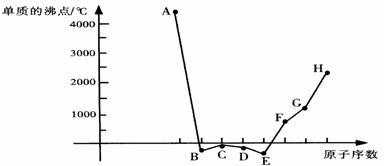
请回答:
(1) 上述元素的最高价氧化物的水化物中,碱性最强的是(写化学式)__________;上述元素的气态氢化物中,最稳定的是(写化学式)________。
(2) 上述元素中,某些元素的常见单质所形成的晶体为分子晶体,这些单质的分子式是
_________________________________________________。
(3) 已知D、F、G三种元素的离子均具有跟Ne相同的电子层结构,则三种离子的半径由大到小的次序为(用相关元素的离子符号表示) > > 。
[xxi].(12分)分子式为C13H16O2的惕各酸苯乙酯广泛用于香精的调香剂。已知:
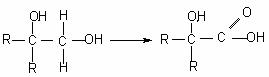
为了合成该物,某实验室的科技人员设计了下列合成路线:
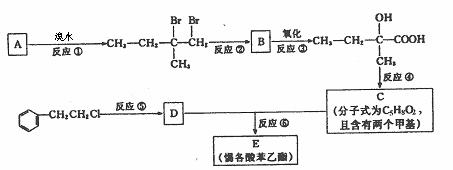
试回答下列问题:
(1) 试写出:A的结构简式_______________;B的结构简式________________。
(2) 反应②中另加的试剂是_______________;反应④的一般条件是______________。
(3) 试写出反应生成E的化学方程式:____________________________________________。
(4) 上述合成路线中属于取代反应的是 (填编号)。
[xvii].(4分)下列说法中,不正确的是____________(填序号,多选扣分)
A.实验室制乙烯时,在酒精和浓硫酸的混合液中,放入几片碎瓷片,加热混合物,使液体温度迅速升到170℃
B.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置,待液体分层后,滴加硝酸银溶液
C.用蒸馏法分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃)
D.验证蔗糖水解产物时,在蔗糖溶液中加几滴稀硫酸,水浴5min,加入新制银氨溶液
E.将一定量CuSO4和NaOH溶液混合后加入甲醛溶液,加热至沸腾,产生黑色沉淀,原因可能是NaOH量太少
F.把汽油贮放在带橡皮塞的玻璃瓶中
G.实验室中进行的下列实验需水浴加热:①乙酸乙酯的制备②葡萄糖的银镜反应
[xviii].(16分)苯甲酸甲酯是一种重要的工业原料,有机化学中通过酯化反应和水解反应的原理,可以进行苯甲酸甲酯的合成和皂化反应。有关物质的物理性质见下表所示:
|
|
苯甲酸 |
甲醇 |
苯甲酸甲酯 |
|
熔点/℃ |
122.4 |
-97 |
-12.3 |
|
沸点/℃ |
249 |
64.3 |
199.6 |
|
密度/g·cm-3 |
1.2659 |
0.792 |
1.0888 |
|
水溶性 |
微溶 |
互溶 |
不溶 |
Ⅰ 苯甲酸甲酯的合成和提纯
相关的实验步骤为:
第一步:将过量的甲醇和苯甲酸混合加热发生酯化反应
第二步:水洗提纯
第三步:蒸馏提纯
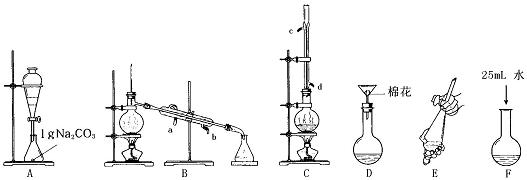
(1) 上述是合成和提纯的有关装置图,请写出合成和提纯苯甲酸甲酯的操作顺序(填字母)___________________。
(2) C装置中除了装有15g苯甲酸和20mL过量的甲醇外还需要________________、,________________。作用分别是________________、________________。
(3) C装置中冷凝管的作用是__________________,A装置中固体Na2CO3作用是________
___________________________。
Ⅱ 苯甲酸甲酯的皂化反应
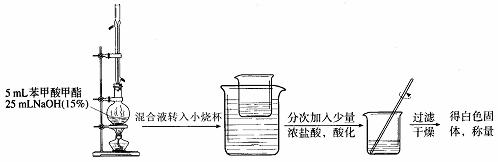
G H I
(4) 能说明G装置中反应完全的现象是________________________________________。
(5) 在Ⅱ中得到白色固体的质量为5g。假设反应I和反应Ⅱ中:蒸馏提纯的效率为66.7%,加浓盐酸苯甲酸钠生成白色固体的转化率为80%,酯化反应中苯甲酸的转化率为X。其他步骤的转化效率为100%。则X=____________。
[ix].阿伏加德罗常数约为6.02×1023mol-1。下列叙述中正确的是
A.标准状况下,1 mol汽油所占的体积约为22.4 L
B.1mol C3H8分子中共价键总数约为10×6.02×1023
C.标准状况下,2.24 L 乙醛完全燃烧所得CO2分子数约为0.2×6.02×1023
D.1mol 甲基所含电子数约为8×6.02×1023
[x].利尿酸在奥运会上被禁用,其结构简式如下图所示,下列叙述正确的是
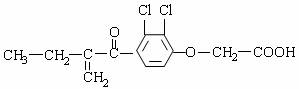
A.该有机物的分子式是C13H10Cl2O4
B.利尿酸能与FeCl3溶液发生显色反应
C.1 mol利尿酸能与5 mol H2发生加成反应
D.利尿酸分子内处于同一平面的原子不超过10个
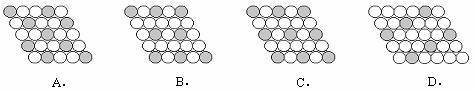
[xi].下面二维平面晶体所表示的化学式为AX3的是
[xii].为提纯下列物质(括号内为少量杂质),所选用的除杂试剂与主要方法都正确的是
不纯物质 除杂试剂 方法
A.硬脂酸钠(甘油) NaCl 盐析
B. 乙醇(乙酸) 水 分液
C. 甲烷(乙烯) 酸性KMnO4溶液 洗气
D. 甲苯(苯酚) 浓Br2水 过滤
[xiii].下列各组离子在指定溶液中,可以大量共存的是
A.无色溶液中:K+、Cl-、PO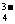 、SO
、SO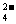
B.pH=11的溶液中:CO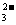 、Na+、ClO-、S2-
、Na+、ClO-、S2-
C.水电离出的H+浓度c(H+)=10-12mol·L-1的溶液中:Cl-、NO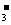 、NH
、NH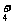 、S2O
、S2O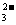
D.加入铝能放出H2的溶液中:Mg2+、NH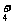 、Cl-、K+
、Cl-、K+
[xiv].莫尔盐[(NH4)2Fe(SO4)2·6H2O]常作氧化还原滴定法的基准物质,在0.1mol/L的该盐的溶液中,下列有关比较不正确的是
A.c(SO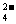 )> c(NH
)> c(NH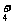 )>c(Fe2+)>c(H+)>c(OH-)
)>c(Fe2+)>c(H+)>c(OH-)
B.c(NH3·H2O)+c(NH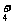 )= 0.2mol/L
)= 0.2mol/L
C.2 c(SO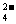 )+ c(OH-)= c(NH
)+ c(OH-)= c(NH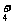 )+2 c(Fe2+)+c(H+)
)+2 c(Fe2+)+c(H+)
D.c(H+)= c(OH-)+c(NH3·H2O)
[xv].a mL3种气态烃的混合物和足量氧气混合点燃后恢复到原来的状态(常温常压),气体体积共缩小了2a mL(不考虑CO2的溶解)。则这3种烃可能的组合是
A.C2H6、C4H6、C2H2同条件下体积比为2:1:2
B.CH4、C3H6、C2H2保持V(C3H6):V(C2H2)=1:2
C.CH4、C2H4、C3H4任意体积比
D.C3H8、C4H8、C2H2质量比为11:14:26
[xvi].将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
 A.
B.
C.
D.
A.
B.
C.
D.
[i].韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成了“暖冰”。下列关于“暖冰”的说法不正确的是
A.“暖冰”也是水分子间通过氢键结合而成的固体
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.形成20℃时的“暖冰”的变化是物理变化
D.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
[ii].不具有放射性的同位素称之为稳定同位素,近20年来,稳定同位素分析法在植物生理学、生态学和环境科学研究中获得广泛应用。如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用做环境分析指示物。下列说法中正确的是
A.34S原子核内的中子数为16
B.13C和15N原子核内的质子数相差2
C.1H216O在相同条件下比1H218O更易蒸发
D.2H+的酸性比1H+的酸性更强
[iii].下图是一种有机物的比例模型。该模型代表的有机物可能是
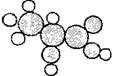 A.羟基羧酸
B.饱和一元醇
A.羟基羧酸
B.饱和一元醇
C.羧酸酯 D.饱和一元醛
[iv].下列实验方法不能达到目的的是
A.用分液法分离水和乙酸乙酯的混合物
B.用四氯化碳萃取溶解在水的碘
C.用盐析法分离油脂皂化反应的产物
D.在氯化铁溶液中滴加氢氧化钠溶液并不断振荡以制备氢氧化铁胶体
[v].发生原电池的反应通常是放热反应,在理论上可设计成原电池的化学反应是
A.C(s)+H2O(g)=CO(g)+H2(g);ΔH>0
B.Ba(OH)2·8H2O+2NH4Cl(s)=BaCl2(aq)+2NH3·H2O(l)+8H2O(l);ΔH>0
C.CaC2(s)+2H2O(l)=Ca(OH)2(s)+C2H2(g);ΔH<0
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH<0
[vi].目前人类已发现的非金属元素除稀有气体外,共有16种,下列对这16种非金属元素的相关判断:
①都是主族元素,最外层电子数都大于4
②单质在反应中都只能作氧化剂
③氢化物常温下都是气态,所以又都叫气态氢化物
④氧化物常温下都可以与水反应生成酸
A.只有②③正确 B.只有①③正确
C.只有④正确 D.①②③④均不正确
[vii].纯净的氯化钠是不潮解的,但粗盐很容易潮解,这主要是因为其中含有杂质MgCl2的缘故。为得到纯净的氯化钠,有人设计了一个实验:把买来的粗盐放入纯氯化钠饱和溶液一段时间,过滤,洗涤,可得纯净的氯化钠晶体。则下列说法中,正确的是
A.粗盐的晶粒大一些有利于提纯
B.设计实验的根据是MgCl2比NaCl易溶于水
C.设计实验的根据是NaCl的溶解平衡
D.在整个过程中NaCl饱和溶液浓度会变大(温度不变)
[viii].已知乙烯和乙炔燃烧的热化学方程式分别为:
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH= -2600 kJ·mol―1
C2H4(g)+3O2(g)=2CO2(g)+2H2O(l);ΔH= -1411 kJ·mol―1
又知氧炔焰的温度比乙烯燃烧时火焰的温度高。据此,下列说法错误的是
A.物质的燃烧热越大,火焰温度越高
B.烃完全燃烧时,火焰温度的高低不仅仅取决于其燃烧热的高低
C.相同条件下等体积乙烯和乙炔完全燃烧时,乙炔放热较少
D.1mol乙烯完全燃烧生成气态产物时,放出的热量小于1411 kJ
25.自然界存在一种被称为白云石的矿石,其化学式是xCaCO3 .yMgCO3。以它为原料,可制取耐火材料等。
⑴称取mg白云石,经充分加热,可以生成耐火材料MgO多少摩尔?(用含m、x、y的代数式表示)。
⑵称取27.6g白云石,高温加热到质量不再变化,收集到CO2体积6.72L(标准状况),求白云石的化学式(取x、y的最小正整数比)。
⑶将上述收集到的6.72L CO2通入200mL 2.25mol/LNaOH溶液中,充分反应后,试确定溶液中的溶质及其物质的量之比(不考虑离子的水解)。
⑷已知:CaO+3C CaC2+CO
;
2MgO+5C
CaC2+CO
;
2MgO+5C Mg2C3+2CO。
Mg2C3+2CO。
若称取白云石mg,研碎后与过量炭粉混合,放在特定仪器中隔离空气强热一段时间后,测得白云石分解率为a,生成VL(标准状况)一氧化碳。
①试列出V的计算式(用含m、a的代数式表示)
②请在下图中画出V和a的关系图。

24.实验室定量分析某样品中亚硫酸钠的一种方法是:
①在1.520g样品中加入碳酸氢钾溶液、0.13% I2的氯仿溶液,在分液漏斗中振荡15min。离子方程式为:SO32-+I2+2HCO3-=SO42-+2I-+2CO2↑+H2O。
②取①中所得的水溶液,加入一定量乙酸、足量的饱和溴水溶液,充分振荡,其中碘离子被氧化成碘酸根离子,得到250mL溶液。
③在②所得溶液中取25mL,滴加甲酸,除去其中过量的Br2。
方程式为:Br2+HCOOH=2HBr+CO2↑
④将③所得溶液中加适量的醋酸钠,再加入足量的碘化钾溶液,振荡溶液。
⑤用标准的硫代硫酸钠溶液滴定④中所得溶液,共消耗0.1120mol/L Na2S2O3 15.10mL。离子方程式为:I2+2S2O32-=2I-+S4O62-。回答下列问题:
⑴写出②、④两步操作中所发生反应的离子方程式。
⑵①中为什么要用0.13% I2的氯仿溶液,而不直接用I2的水溶液?
⑶计算样品中亚硫酸钠的质量百分含量。
23.已知 (注:R,R’为烃基)
(注:R,R’为烃基)
A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品。A能发生如下图所示的变化。
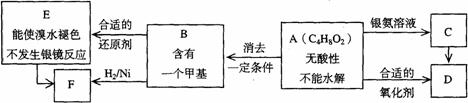
试回答
⑴写出符合下述条件A的同分异构体结构简式(各任写一种):
①酸性______________________;②能发生水解反应______________________;
⑵A分子中的官能团是_____________,D的结构简式是_____________;
⑶C→D的反应类型是_____________,E→F的反应类型是___________;
⑷写出化学方程式:A→B_________________________________________。
⑸写出E生成高聚物的化学方程式:____________________________________。
⑹C的同分异构体Cl与C有相同官能团,两分子Cl脱去两分子水形成含有六元环的
C2,写出C2的结构简式:______________________________。
22.有机化合物A广泛存在于水果肉中,尤以苹果、葡萄、西瓜、山楂内为多。已知:
①A中碳、氢的质量分数和为40.3%,其余为氧;相对分子质量大于110,小于150。
②A与乙酸或丙醇在浓硫酸、加热的条件下生成有香味的产物;
③1molA与足量的钠最多能产生1.5 mol气体;
④A在一定温度下脱水得到产物B(不是环状化合物),B可以和溴水发生加成反应。
试回答:
⑴A的分子式为 。
⑵对A的结构可作出的判断是 。
A.肯定有碳碳双键 B.有两个羧基 C.肯定有羟基 D.有-COOR官能团
⑶有机物A的结构简式(不含一CH3)为 。
⑷A在一定温度下的脱水产物B具有顺反异构现象,B和溴水反应的化学方程式:
。
21.聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·XH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣--铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:

⑴搅拌加热操作过程中发生反应的离子方程式
; 。
⑵生产过程中操作B和D的名称分别是 和 。
⑶反应中副产品a是 。
⑷生产过程中可循环使用的物质是 (用化学式表示)。
⑸调节pH至4.0~4.5的目的是 。
⑹实验室要测定水处理剂产品中n和x的值。为使测定结果更准确,需得到的晶体较纯净。生产过程中C物质可选用 。
A.NaOH B.Al C.氨水 D.Al2O3 E.NaAlO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com