
9.类推的思维方法在化学学习与研究是很重要的,但还要综合考虑其它因素,特别要经过实践的检验,否则常会产生错误的结论。下列几种类推结论中你认为正确的是 ( )
 A.从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构
A.从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构
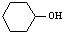 B. 能与溴水发生取代反应;
也可以与溴水发生取代反应
B. 能与溴水发生取代反应;
也可以与溴水发生取代反应
C.NaCl与CsCl化学式相似,故NaCl与CsCl的晶体结构也相似
D.CO2通入Ca(ClO)2溶液生成CaCO3和HClO,SO2通人Ca(ClO)2溶液也生成CaSO3和HClO
|

A.该有机物不属于芳香烃 B.该有机物属于苯的同系物
C.该有机物分子中含有22个碳原子 D.该有机物一氯代物只有3种
8.某溶液中大量存在的五种离子:NO3-、SO42-、Fe3+、H+、M,其物质的量之比为:n(NO3-):n(SO42-):n(Fe3+):n(H+):n(M)=2:3:1:3:1,则M可能为 ( )
A.Fe2+ B.Mg2+ C.CO32- D.Ba2+
7.向一种溶液中滴加另一种溶液后,溶液的颜色不发生变化的是 ( )
A.硫酸铁溶液中滴加硫氰化钾溶液 B.淀粉碘化钾溶液中滴加碘水
C.稀盐酸中滴加碳酸氢钠溶液 D.高锰酸钾酸性溶液中滴加亚硫酸钠溶液
6.下列各选项中两种粒子所含电子数不相等的是 ( )
A.羟甲基(-CH2OH)和甲氧基(CH3O-)
B.亚硝酸(HNO2)和亚硝酸根(NO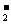 )
)
C.硝基(-NO2)和二氧化氮(NO2)
D.羟基(-OH)和氢氧根(OH-)
5.下列叙述中不正确的是 ( )
A.电解池的阳极上发生氧化反应,阴极上发生还原反应
B.原电池跟电解池连接后,电子从电池负极流向电解池阳极
C.电镀时,电镀池里的阳极材料发生氧化反应
D.电解饱和食盐水时,阳极产生氯气
4.目前,科学家已探测出水星大气中含有一种称为硫化羰(化学式为COS)的物质,已知硫化羰与二氧化碳的结构相似,但能在氧气中完全燃烧,下列有关硫化羰的说法正确的是 ( )
A.硫化羰是非极性分子
B.硫化羰在氧气中完全燃烧后的产物是CO2和SO2
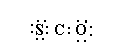 C.硫化羰肯定是一种很好的灭火剂
C.硫化羰肯定是一种很好的灭火剂
D.硫化羰的电子式为
3.下列说法不正确的是 ( )
A.NaOH、SO2、CH2=CH2 都能使溴水褪色,但原理各不相同
B.活性炭、氯气和二氧化硫都能使品红溶液褪色,且原理相同
C.Al、NaHCO3、CH3COONH4既能跟盐酸反应,又能跟烧碱溶液反应
D.C6H5OH、FeSO4溶液、Na2SO3溶液在空气中都易因氧化而变质
2.有机物 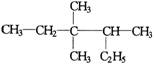 的正确命名为 ( )
的正确命名为 ( )
A.2-乙基-3,3-二甲基-4-乙基戊烷 B.3,3-二甲基-4-乙基戊烷
C.2,3,3-三甲基已烷 D.3,3,4-三甲基已烷
1.化学与生活是紧密相联的,下列关于生活化学的说法正确的是 ( )
A.随着人们生活节奏的加快,方便的小包装食品已被广泛接受,为了防止富脂食品氧化变质,延长食品的保质期,通常是在包装袋中放入生石灰。
B.现在用的清洁燃料主要有两类:一类是压缩天然气,另一类为液化石油气,他们属于碳氢化合物
C.福尔马林是一种良好的杀毒剂,也可用来消毒自来水
D.保护加酶洗衣粉的洗涤效果,应在热水溶解洗衣粉
[xxiii].(8分)现有A、B两种链状饱和一元醇的混合物0.3mol,其质量为13.8g,已知A和B碳原子均不大于4,且A<B。
(1) 混合物中A可能的分子式__________,B可能的分子式__________________;
(2) 若n(A):n(B)=1:1时,A的名称__________,B的名称__________________________。
[xxiv].(11分)某研究性学习小组对铝热反应实验展开研究。现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
|
物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
-- |
Ⅰ.
(1) 某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_________________(填“合理”或“不合理”)
(2) 设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_______________,反应的离子方程式为_________________________________。
(3) 实验室溶解该熔融物,下列试剂中最好的是____________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ . 实验研究发现,硝酸发生氧化还原反应时,硝酸
. 实验研究发现,硝酸发生氧化还原反应时,硝酸
的浓度越稀,对应还原产物中氮元素的化合价越
低。某同学取一定量上述的熔融物与一定量很稀的
硝酸充分反应,反应过程中无气体放出。在反应结
束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶
液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的
物质的量(mol)的关系如图所示。试回答下列问题:
(1) 图中OC段没有沉淀生成,此阶段发生反应的离子方程式为______________________。
(2) 在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为___________;
上述现象说明溶液中________________结合OH-的能力比________强(填离子符号)。
(3) B与A的差值为_________mol。
(4) B点对应的沉淀的物质的量为______mol,C点对应的氢氧化钠溶液的体积为_____mL。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com