
20.(12分)有机物A(C10H20O2)具有兰花香味,可用作香皂、洗发香波的芳香赋予剂。
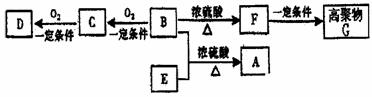
已知:
①B分子中没有支链。
②D能与碳酸氢钠溶液反应放出二氧化碳。
③D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被Cl取代,其一氯代
物只有一种。
④F可能使溴的四氯化碳溶液褪色。
回答下列问题:
(1)B不能发生的反应有 (选填序号)。
①取代反应 ②消去反应 ③加聚反应 ④氧化反应
(2)D、F分子所含有官能团的名称依次是 、 。
(3)写出D、E的同分异构体的可能的结构简式(具有相同官能团):
。
(4)由F可制得高聚物G,该反应的化学方程式是 。
(5)E可用于生产氯苄青霉素等。已知E的制备方法不同于其常见的同系物,据报道,
 CH3
CH3
可由2-甲基-1丙醇(CH3-CH-CH2-OH)和甲酸在定条件下制取E。该反应的化学方程式 。
19.(8分)某同学设计了如下方案,来测定过氧化钠的样品的纯度(杂质不参加反应,条件为标准
状况)。
实验原理:2Na2O2 + 2H2O = 4NaOH + O2↑
通过测定生成的氧气的体积,经计算可确定样品过氧化钠的质量。
 实验步骤:
实验步骤:
① 称取过氧化钠固体2.00 g ;
② 把这些过氧化钠放入气密性良好的气体发生装置中;
③ 向过氧化钠中滴入水,用量筒排水集气,量筒内液
面在110 mL处恰与水槽内液面相平;
④ 作为反应器的烧瓶中有54.0 mL液体;
⑤ 将烧瓶内的液体转移到250 mL的容量瓶内,并加水定容。
请回答下列问题:
(1)生成气体体积是 mL。
(2)据研究,与上述反应同时发生的反应还有 : Na2O2 + 2H2O = 2NaOH + H2O2
H2O2的生成会使测定结果 (偏高或偏小)。
(3)为校正实验结果,该学生补做了如下实验:用移液管移取20.00 mL容量瓶中的液
体,放入锥形瓶中,用0.0100 mol/L的KMnO4溶液去测定,至溶液中刚好出现浅浅的紫红色,停止滴定,用去了24.00 mLKMnO4溶液。配平化学反应式方程式:
KMnO4 + H2O2 + H2SO4 -- K2SO4 + MnSO4 + O2↑ + H2O,
该实验应选用 式滴定管。
(4)通过以上数据计算,该过氧化钠的纯度为 。
(5)如何避免因为生成H2O2造成的误差? 。
18.(5分)向稀氢氧化钠溶液中滴加几滴酚酞试液,溶液变为红色,再逐滴滴加新制氯水,溶液颜色逐渐变浅并褪去。请你预测产生此现象的可能原因,并设计实验方案证明你的判断。
预测1:____________________________________________________________________
___________________________________________________________________________
实验方案:________________________________________________________________
预测2:____________________________________________________________________
___________________________________________________________________________
实验方案:________________________________________________________________
预测3:____________________________________________________________________
___________________________________________________________________________
实验方案:________________________________________________________________
(注意:以上填空根据你的判定,不一定要填满3个预测。)
17.(8分)已知化合物A~M均为中学化学常见物质,它们之间存在如下图所示的转化关系。A、B、F、L均可形成原子晶体,其中B、F为非金属单质,D为金属单质,其余均为化合物;E、H、K均属于汽车尾气中的大气污染物,其中E、K均能与人体内血红蛋白结合使人中毒,H是一种红棕色气体;I常温时为无色液体;A、F、L含有同种元素;A与B在高温下能发生反应,当B的用量不同时,反应物与生成物种类有如下图的示的转化关系①和②;C的稀溶液跟D发生反应时,也会因为D的用量不同,发生如下图所示的④、⑤反应,而生成不同的产物。
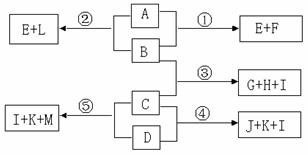
|
(1)写出C、E、H的化学式C 、E 、H ;
(2)反应③中,氧化剂和还原剂的物质的量之比为 ;
(3)用方程式表示①的反应过程_____________________________________________;
(4)从A~F中选择合适的物质,用离子方程式完成J和M的相互转化:
。
16.(6分)(1)A、B、C是周期表中相邻的三种元素,已知它们的原子半径和核电荷大小顺序均为A>B>C,三种元素的原子核中质子数之和为15,由此推断A、B、C元素分别是
A: B: C: (填写元素符号)。
|
,利用此反应制得
1molBr2转移电子有________________个。
15.室温下,某无色溶液中由水电离得到的c(H+)和c(OH-)的乘积为1×10-24,该无色溶液中可能大量共存的离子组是 ( )
A.AlO2-、K+、NH4+、Na+ B.K+、S2-、SO32-、Na+
C.Na+、Fe2+、Br-、Cl- D.S2-、K+、Cl-、HCO3-
14.下列说法不正确的是 ( )
A.0.2mol/L的NaHCO3溶液中:[Na+]>[HCO3-]>[OH-]>[H+]
B.叠氮酸(HN3)与醋酸酸性相似,NaN3水溶液中离子浓度大小顺序为:
c(Na+)>c(N3-)>c(OH-)>c(H+)
C.向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:[NH4+] = [Cl-]
D.pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7
13.NA代表阿伏加德罗常数,以下说法正确的是 ( )
A.由2H和18O所组成的水10g,其中所含的中子数为5NA
B.标准状况下,1L庚烷完全燃烧后,所生成气态产物的分子数为7/22.4NA
C.在1L0.1mol/L的HCOOH溶液中,所含HCOO-与HCOOH粒子数之和为0.1NA
D.1molS与足量Cu反应生成Cu2S转移NA个电子
12.下列离子方程式正确的是 ( )
A.等物质的量浓度的FeBr2和CuCl2混合溶液用惰性电极电解最初发生:
Fe 2+
+ 2Cl-  Fe +Cl2↑
Fe +Cl2↑
B.氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑
C.氯酸钾与浓盐酸制取少量氯气:6H+ + ClO3- + Cl- = Cl2 ↑ +3H2O
D.次氯酸钙溶液中通入过量二氧化碳
Ca2++2ClO-+ H2O + CO2= CaCO3↓+2HClO
11.近来,媒体报道不法商贩销售“致癌大米”,已验证这种大米中含有黄曲霉毒素(AFTB),
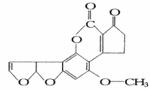 其分子结构式为如右图所示,人体的特殊基因在黄曲霉素的作用下会发生突变,有转变为肝癌的可能。一般条件下跟1mol AFTB起反应的H2或NaOH的最大量分别是( )
其分子结构式为如右图所示,人体的特殊基因在黄曲霉素的作用下会发生突变,有转变为肝癌的可能。一般条件下跟1mol AFTB起反应的H2或NaOH的最大量分别是( )
A.6mol;1mol B.5mol;1mol
C.6mol;2mol D.5mol;2mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com