
3.下列物质:①干冰,②石英,③白磷,④氯仿,⑤过氧化钠。其中含极性键的非极性分子是
A.②③⑤ B.仅②③ C.仅① D.①③④
2. 下列事实不能用勒沙特列原理解释的是
A.将氯化铁溶液加热蒸干最终得不到氯化铁固体
B.钢铁在潮湿的空气中容易生锈
C. 实验室可用排饱和食盐水的方法收集氯气
D.常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5
1. 据报道,N5是破坏力极强的炸药之一,18O2是比黄金还贵重的物质。下列说法正确的是
A. 18O2中含18个中子 B. 原子半径:N<18O
C. N5和N2互为同位素 D. 2N5 = 5N2是化学变化
27.(8分)有机玻璃是一种重要的塑料,有机玻璃的单体A(C5H8O2)不溶于水,并可以发生以下变化:
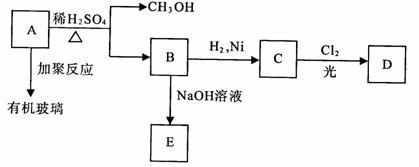
请回答:
(1)B分子中含有的官能团是_____________, _____________.
(2)由B转化为C的反应属于(选填序号) _____________.
①氧化反应 ②还原反应 ③加成反应 ④取代反应
(3)C的一氯代物D有两种,C的结构简式是_____________.
(4)由A生成B的化学方程式是_____________.
(5)有机玻璃的结构简式是_____________.
26.(12分)(1)化合物A(C4H10O)是一种有机溶剂。A可以发生以下变化:
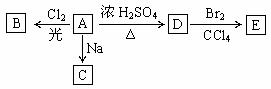
① A分子中的官能团名称是 。
② A只有一种一氯取代物B。写出由A转化为B的化学方程式: 。
③ A的同分异构体F也可以有框图内A的各种变化,且F的一氯取代物有三种。则F的结构简式是 。
(2)化合物“HQ”(C6H6O2)可用作显影剂,“HQ”可以与三氯化铁溶液发生显色反应。“HQ”还能发生的反应是(填序号)
① 加成反应 ②氧化反应 ③加聚反应 ④水解反应
“HQ”的一硝基取代物只有一种。“HQ”的结构简式是 。
(3)A和“HQ”在一定条件下相互作用形成水与一种食品抗氧化剂“TBHQ”。 “TBHQ”与氢氧化钠溶液作用得到化学式为C10H12O2Na2的化合物。“TBHQ”的结构简式是 。
23.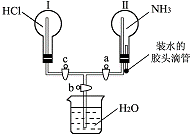 (6分)利用右图所示的装置,可以验证NH3和HCl的有关性质。
(6分)利用右图所示的装置,可以验证NH3和HCl的有关性质。
实验前a、b、c活塞均关闭。
(1) 通过挤压胶头滴管和控制活塞的开关,若要在 烧瓶Ⅱ中产生“喷泉”现象,烧瓶Ⅰ中不产生“喷泉”现象,其操作方法是 ____________________________________________________。
(2) 通过挤压胶头滴管和控制活塞的开关,在烧瓶Ⅰ中产生“喷泉”现象,烧瓶Ⅱ中不产生“喷泉”现象,其操作方法是 _____________________________________________________________________________________________________。
24(18分)无水氯化铝是白色晶体,易吸收水分,在178℃升华,装有无水氯化铝试剂瓶久置潮湿空气中,会自动爆炸产生大量白雾,氯化铝常作为有机合成和石油工业的催化剂等。
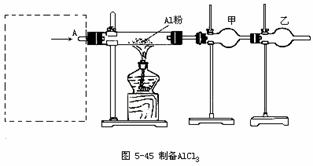 图5-45是实验室制取少量无水氯化铝装置的一部分,在方框中安装某些仪器,便是该装置的另一部分,从A口通入某种气体,即可制取无水氯化铝。现提供的试剂除装置中已有的铝粉和碱石灰外,还有NaCl固体、MnO2、浓H2SO4和水,而提供的安装方框中装置的仪器不限,用上述方法制取无水氯化铝,请回答下列问题:
图5-45是实验室制取少量无水氯化铝装置的一部分,在方框中安装某些仪器,便是该装置的另一部分,从A口通入某种气体,即可制取无水氯化铝。现提供的试剂除装置中已有的铝粉和碱石灰外,还有NaCl固体、MnO2、浓H2SO4和水,而提供的安装方框中装置的仪器不限,用上述方法制取无水氯化铝,请回答下列问题:
(1)利用上述条件,可制取的气体有(填化学式) ____ __;
(2)若要安全、顺利地制取无水氯化铝,通入A口的气体应是 ______;
(3)用中学化学实验室常用的方法制取通入A口的气体的反应方程式是___ ___
(4)用(3)的方法制得的气体中可能还含有的气体有 ___ ___,通入A口前是否有必要除去,不必除去或必须除去的原因是____ __;
(5)按(3)的方法安装方框图中的装置,所需要的玻璃仪器(同一种仪器,数量在2件或2件以上的要写明件数)有_____ _;
(6)装置图中甲、乙两支干燥管中需要填充碱石灰的是(填甲或乙或甲、乙)______,甲的作用是____ __,乙的作用是___ ___。
25(14分)维生素C(水溶液呈酸性)具有明显的抗衰老作用,但易被空气氧化。新鲜水果、蔬菜、乳制品中都富含维生素C。如新鲜橙汁中维生素C的含量在500mg/L左右。某课外小组利用碘滴定法测某橙汁中维生素C 的含量,其反应原理为:

(1) 下列说法中正确的是( )
(A) 上述反应为取代反应 (B) 滴定时可用淀粉溶液作指示剂
(C) 滴定时可用甲基橙作指示剂 (D) 锥形瓶不能用待测橙汁润洗。
(2) 上述实验前要配制7.50×10-3mol/L的标准碘溶液100 mL。除玻璃棒外,还需要的玻璃仪器有______________等(填编号) (A) 容量瓶 (B)烧杯 (C) 锥形瓶 (D) 烧瓶
(3) 标准碘液放入________(填仪器名称),滴定时,眼睛注视 ,直到滴定终点。滴定至终点的现象是________________。
(4) 滴定过程中能否剧烈摇动锥形瓶______(填能或不能)。为什么_____________________。
(5) 若经数据处理,滴定中消耗的标准碘溶液的体积是15.00 mL ,锥形瓶中注入的待测橙汁是20.00mL,则此橙汁中维生素C的含量是____________mg/L 该橙汁______(填“是”或“不是)纯天然的新鲜橙汁
22、(12分)同周期中A、B、C、D、E、F为原子序数依次增大的短周期元素。已知A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水。请回答下列问题:
(1)根据以上条件判断出符合题意的元素,请写出相应的元素名称:
A________、B_______、C______、D_______、E_______、F______。
(2)画出B的原子结构示意图:________ ___。
(3)写出C单质与A的最高价氧化物的水化物的水溶液反应的离子方程式:
(4)若1 mol F单质与C的单质恰好完全反应,则等物质的量的C的最高价氧化物与A的最高价氧化物的水化物反应,消耗_________ mol A的最高价氧化物的水化物。
21.(10分)近年来,我国储氢纳米碳管研究获重大进展,电弧法合成的碳纳米管,常伴有大量物质--碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应的化学方程式为:
C+ K2Cr2O7
+ H2SO4(稀) CO2↑+ K2SO4
+ Cr2 (SO4 )
3+ .
CO2↑+ K2SO4
+ Cr2 (SO4 )
3+ .
(1) 完成并配平上述反应的化学方程式。
(2)此反应的氧化剂是 ,氧化产物是 。
(3)H2SO4在上述反应中表现出来的性质是 (填选项编号)
A.酸性 B.氧化性 C.吸水性 D.脱水性
(4)上述反应中若产生11g气体物质,则转移电子的数目为 。
20.在一定量饱和的澄清石灰水中,加入5.60克CaO后充分搅拌,静置恢复到原来的温度,发现石灰水下部有白色不溶物形成,则下列叙述正确的是:
A.白色不溶物为CaO,其质量为5.60克
B.白色不溶物为Ca(OH)2,其质量为7.40克
C.石灰水的浓度和质量均不会变化
D.石灰水的质量将会减少,石灰水的pH不会发生变化
19.羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原。现用25.00mL0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.65mL 0.020mol/L的KMnO4酸性溶液完全作用(已知:FeSO4+ KMnO4+ H2SO4= Fe2(SO4)3+ K2SO4+ MnSO4+ H2O(未配平),则在上述反应中,羟胺的氧化产物是:
A.N2 B.N2O C.NO D.NO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com