
19.液氨溶解金属钠后成为蓝色的导电能力很强的溶液,其颜色被认为是电子的氨合 引起的。若放置一段时间后,蓝色逐渐褪去,蒸发褪色后的溶液得到白色氨基钠(NaNH2),反应的化学方程式为:2Na+2NH3
引起的。若放置一段时间后,蓝色逐渐褪去,蒸发褪色后的溶液得到白色氨基钠(NaNH2),反应的化学方程式为:2Na+2NH3
 2NaNH2+H2↑。下列说法不正确的是
2NaNH2+H2↑。下列说法不正确的是
A.溶液褪色的速率与逸出氢气的速率成正比
B.液氨中有如下平衡:2NH3 
 NH4++NH2-
NH4++NH2-
C.液氨是一种非电解质,在水中才能电离
D.碱金属的液氨溶液是一种强还原剂
18.用电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极。下列说法正确的是
A.当电池负极消耗mg气体时,电解池阳极同时有mg气体生成
B.电池的正极反应式为:02+2H20+4e- →4OH-
C.电解后c(Na2SO4)不变,且溶液中有晶体析出
D.电池中c(KOH)不变;电解池中溶液pH变大
17.常温时,将CH3COOH溶液和NaOH溶液等体积混合后,溶液呈中性。则下列各项正确的是
A.混合前:pH(CH3COOH)+pH(NaOH)=14
B.混合后:c(Na+)=c(CH3COO-)+c(OH-)
C.混合前:c(CH3COOH)>c(NaOH)
D.混合后:c(Na+)>c(CH3C00-)>c(OH-)>c(H+)
16.某温度下,重水(D20)的离子积为1.6×10-15mol2·L-2,可以用类似pH的定义来规定pD=-lg[H+]。在同一温度下,以下关于pD的叙述正确的是
A. pD>7.O,溶液一定呈碱性
B.在1LD20中溶解0.01mol DCl(假设体积仍为1L),其中pD=2.0
C.在1LD20中溶解0.01mol NaOD(假设体积仍为lL),其中pD=12.0
D.在100mL 0.25mol·L-1 DCI溶液中加入100mL 0.25mol·L-1NaOD,pD=7.0(溶液混合时的体积变化忽略不计)
15.在容积不变的密闭容器中存在如下反应:2S02(g)+02(g)
 2S03(g)
△H<0. 某研究小组研究了在其他条件不变时,改变某一条件对上述反应的影响,如图所示:
2S03(g)
△H<0. 某研究小组研究了在其他条件不变时,改变某一条件对上述反应的影响,如图所示:

下列分析错误的是
A.图I研究的是t1时刻增大压强对反应速率的影响
B.图Ⅱ研究的是t1时刻加入催化剂后对反应速率的影响
C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲的催化效率比乙高
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
14.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: 。下列说法错误的是
。下列说法错误的是
A,电池工作时,锌失去电子
B.电池正极的电极反应式为:
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过 电子,锌的质量理论上减小6.5g
电子,锌的质量理论上减小6.5g
13.对于化学反应方向的确定,下列说法正确的是
A.在温度、压强一定的条件下,焓因素和熵因素共向决定一个化学反应的方向
B.温度、压强一定时,放热的熵增加反应一定能自发进行
C.反应焓变是决定反应能否自发进行的唯一因素
D.固体的溶解过程只与焓变有关
12.除去KCl溶液中的少量K2SO4,加入的试剂和顺序均正确的是
A.过量BaCl2-过量Na2C03一HCl
B.过量BaCl2-过量K2C03一HCl
C.过量Ba(N03)2-过量K2C03一HCl
D.过量Ba(N03)2-过量Na2C03一HCl
11.已知下列热化学方程式:
(1)

(2)

(3) 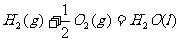

则反应 的焓变为
的焓变为
A.
B.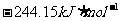
C.
D.
10.下列说法中正确的是
A.在Na3PO4 溶液中,c(Na+)是c(PO43-)的3倍
B. pH为3的盐酸中,其c(H+)是pH为1的盐酸中的3倍
C.O.1mol·L-1KOH溶液和0.1mol·L-1氨水中,其c(OH-)相等
D.在25℃时,无论是酸性、碱性还是中性的稀溶液中,其c(H+)和c(OH+)的乘积都等于
l×10-14
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com