
10.分类方法在化学学科的发展中起到了非常直要的作用。下列分类标准合理的是
①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等;
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应;
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液;
④根据反应中的热效应将化学反应分为放热反应和吸热反应。
A.①③ B.②④ C.①②④ D.②③④
9.2006年3月,温家宝指出“抓好资源节约,建设环境友好燃社会”,这是我闻社会和经济
长期发展的重要保证。你认为下列行为与之相悖的是
A.研制对目标昆虫有毒杀作用的新型、可降解杀虫剂
B.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
C.研制开发以水代替有机溶剂的化工涂料
D.以聚苯乙烯全面代替木材,生产包装盒、快餐盒等以减少木材使用,保护森林
26.(10分)钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿储量居世界首位。含有Fe2O3的钛铁矿(主要成分为FeTiO3)制取TiO2的流程如下:
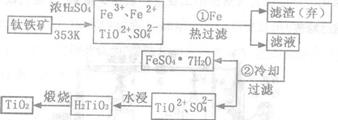
(1)步骤①加Fe的目的是 ;
步骤②冷却的目的是
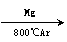 (2)上述制备TiO2的过程中,可以利用的副产物是
;考虑成本和废物综合利用因素,废液中应加入
处理。
(2)上述制备TiO2的过程中,可以利用的副产物是
;考虑成本和废物综合利用因素,废液中应加入
处理。
(3)由金红石(TiO2)制取单质Ti,涉及到的步骤为:TiO2→TiCl4 Ti,反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是
25.(10分)工业上以石油裂解得到的乙烯和1,3-丁二烯为原料,通过下列反应合成高分子化合物H,该物质可用于制造以玻璃纤维为填料的增强塑料(俗称玻璃钢)。
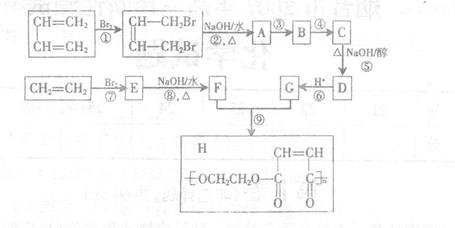
请按要求填空:
(1)写出下列反应的反应类型:① 反应,⑧ 反应。
(2)反应③④中某一步反应是与HCl的加成反应,该反应是 (填反应序号);设计该步反应的目的是
(3)物质D的结构简式是
(4)反应⑨的化学方程式是
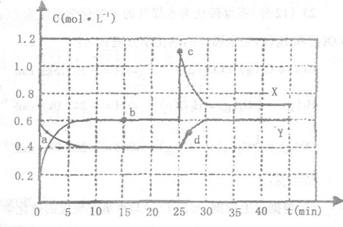
24.(12分)已知NO2和N2O4可以相互转化:
 2NO2(g)
2NO2(g) N2O4(g);△H<0,现将一定
N2O4(g);△H<0,现将一定
量NO2和N2O4的混合气体通入一体积为1L
的恒温密闭容器中,反应物浓度随时间变
化关系如右图所示。根据右图,回答下列
问题:
(1)图中共有两条曲线X和Y,其中曲线
表示N2O4浓度随时间的变化:
a、b、c、d四个点中,表示化学反应处于平衡状态的是 ,并计算该点时反应的平衡常数为
(2)反应进行到25min时,曲线发生变化的原因是 ;若要达到最后相同的化学平衡状态,在25min时还可以采取的措施是 。
A.升高温度 B.缩小容器体积 C.加入催化剂 D.加入一定量的N2O4
说明:下列25、26两小题是选考部分的内容,考生只需选答其中一小题,若选答两小题,则只按
25小题计分。
23.(12分)将煤转化为水煤气的主要化学反应为C(s)+H2O(g)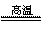 CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
H2(g)+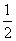 O2(g)=H2O(g) △H=-242.0kJ·mol-1
O2(g)=H2O(g) △H=-242.0kJ·mol-1
CO(g)+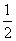 O2(g)=CO2(g) △H=-283.0kJ·mol-1
O2(g)=CO2(g) △H=-283.0kJ·mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸汽反应的热化学方程式:
(2)比较反应热数据可知,1molCO(g)和1molH2(g)完全燃烧放出的热量之和比1molC(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律作出下列循环图:

并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
请分析:甲、乙两同学观点正确的是 (填“甲”或“乙”);判断的理由是
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点
(4)水煤气不仅是优良的气体燃料,也是重要的有机化工原料。CO和H2在一定条件下可以合成:①甲醇 ②甲醛 ③甲酸 ④乙酸。试分析当CO和H2按1:1的体积比混合反应,合成上述
 (填序号)物质时,可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放。
(填序号)物质时,可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放。
22.(14分)某化学小组在实验室模拟工业生产制备少量氨气,他们设计如下图所示装置(图中夹持装置均已略去)
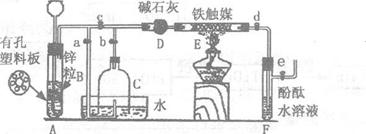
[实验操作]①检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗中注入一定量稀硫酸,则A中有氢气生成。打开弹簧夹c、d、e,在F出口处收集氢气并检验其纯度。
②关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内液面下降到保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
回答下列问题:
(1)检验氢气纯度的目的是
(2)C瓶内液面下降到保持不变时,A装置内发生的现象是 ,防
止了实验装置中压强过大;此时再打开弹簧夹b的主要目的是
(3)在步骤③反应完成后,如何验证反应后的气体中还含有H2、N2?
21.(12分)图中的每一方格表示有关的一种反应物或生成物(反应时加入或生成的水,以及生成沉淀J时的其他产物均已略去)。已知常温下B、C为气态单质,G为固态单质,其余均为化合物。A是由2种短周期元素组成的离子化合物。B形成的氧化物的总电子数比F的总电子数少8,比A的总电子数少18。请填写下列空格:
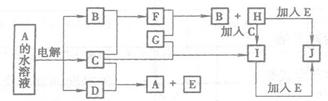
(1)E是 ,I是 ,I溶液蒸干灼烧得 (均填化学式)。
(2)写出C的水溶液与SO2反应的离子方程式
(3)写出I+E→J在水溶液中反应的离子方程式
20.在反应SiO2+3C Sic+2CO中,氧化剂和还原剂物质的量之比是
Sic+2CO中,氧化剂和还原剂物质的量之比是
A.1:3 B.3:1 C.1:2 D.2:1
第Ⅱ卷(非选择题,共60分)
19.下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)=CO2(g) △H1; C(s)+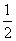 O2(g)=CO(g) △H2
O2(g)=CO(g) △H2
②S(s)+O2(g)=SO2(g) △H3; S(g)+O2(g)=SO2(g) △H4
③2H2(g)+O2(g)=2H2O(g) △H5; 2H2(g)+O2(g)=2H2O(1) △H6
④CaCO3(s)=CaO(s)+CO2(g) △H7; CaO(s)+H2O(1)=Ca(OH)2(s) △H8
A.① B.④ C.②③④ D.①②③
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com