
32.(8分)[化学-物质结构与性质]
F图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。

(1)请写出上图中d单质对应元素原子的电子排布式 。
(2)单质a、b、f对应的元素以原子个数比1:1:1形成的分子中含 个 键,
键,
个 键。
键。
(3)a与b的元素形成的10电子中性分子X的空间构型为 ;将X溶于水后的溶液滴入到含d元素高价离子的溶液中至过量,生成的含d元素离子的化学式为 ;其中X与d的高价离子之间以 键相结合。
(4)下列是上述六种元素中的一种元素形成的含氧酸的结构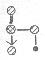 ,请简要说明该物质易溶于水的原因
。
,请简要说明该物质易溶于水的原因
。
31.(8分)[化学-化学与技术]
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
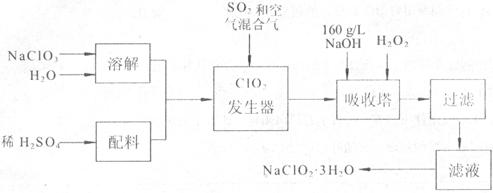
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶出NaClO2、3H2O
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
(1)发生器中鼓入空气的作用可能是 。
(2)吸收塔内的反应的化学厅程式为 。
吸收塔的温度不能超过20℃,其目的是防止H2O2分解,写出H2O2分解的化学方程式:
。
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 。
(4)从滤液中得到NaClO2﹒3H20粗晶体的实验操作依次是 。
30.(16分)工业和交通运输业的迅速发展,机动车数量的日益增多,人类向大气中大量排放烟尘和S02等有害气体等,对大气造成了严重的污染。一研究性学习小组对某市的空气污染情况和SO2参与的反应进行了研究。
(1)空气污染易形成酸雨。从环境保护的角度认为:雨水的pH<5.6时,就判断为酸m。,
该小组同学测定某次雨水中只含硫酸,且浓度为5×10-5mol.L,这次降雨 (填是或不是)酸雨。
(2)该小组同学欲测定空气(含氮气、氧气、 二氧化碳、 二氧化硫等)中,SO2,的体积百分含量(标况),请利用溴水、BaCl2溶液及必要的实验仪器设计实验方案,写出简要的实骤 。
上述实验过程中发生反应的离子方程式为 ,其中SO2参与的反应中,SO2显 性。
(3)在T℃时,反应 ‹0的平衡常数K=6×102,则
‹0的平衡常数K=6×102,则
①温度升高,化学平衡移动后,平衡常数K值 (填“增大”、“减少”或“不变”)。
②在T℃时,某生向容积为2 L的密闭容器中充入0.4 mol SO2、0.18 molO2和 1.2 mol SO3混合气体,此时该反应是否处于化学平衡状态 (填“是”或“否”),化学反应速率v(正)
v(逆)(填“大于”、“等于”或“小于”),你判断的依据是 。
[选做部分]
29.(12分)完成下列各题
(1)将一定量镁粉逐渐投入饱和FeCl3的黄色溶液中,首先看到溶液变成红褐色,并产生气
泡;后来有少量的红褐色沉淀生成。请回答下列问题:
①红褐色溶液是 ,气泡的成分是 。
②用简洁的文字和反应方程式解释该实验的现象
(2)已知KSP(Fe(0H)3)==1.25×10-38,KSP(Mg(OH)3)=1.8×10-11,当溶液中某离子的浓度小于1×10-5mol.L-1时,可认为该离子已沉淀完全。又知:lg2=0.3,lg5=0.7,则在Fe3+和Mg2+的浓度均为0.1 mol.L-1的溶液中:
①什么沉淀也不生成的最大pH应控制为 ;
②已知:pH=-4时,c(Fe 3+)小于1 mol.L-1,通过数据分析说明,控制溶液的pH是否可将Fe3+和Mg2+完全分 离
。
mol.L-1,通过数据分析说明,控制溶液的pH是否可将Fe3+和Mg2+完全分 离
。
28.(14分)在当代,能源同信息、材料一起构成了现代文明的三大支柱。碳元索是能源领域
的主角之一,材料和医学领域等也与碳元素息息相关。
(1)X、Y、Z是短周期中除碳外的非金属元素,它们在周期表中分处于三个不同的周期且原子序数依次增大;X分别与Y和Z以原子个数比1:1相结合时均可形成18电子的分子。请写出三个符合下列条件的化学方程式:
a.所有的反应物和生成物都由×、Y、Z及碳四种元素中的一种或两种组成;
b.反应物中有单质参加且只有一种,三个反应中的单质不同。
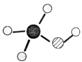
(2)由元素X、Y及碳组成的化合物A的球棍结构如右图:
|
利川A、 |
利用A、O2和KOH可组成燃料电池,则在该电池正极发生反应的物质是 ,负极的电极反应式为 ;
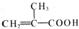
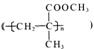 (3)有机玻璃
是由A和通过 和
(3)有机玻璃
是由A和通过 和
反应合成的,该合成反应第一步的化学方程式为 。
15.向某稀HNO3和Fe(NO3)3的混合溶液中逐渐加入铁粉,产生无色气体,该气体遇到空气变红棕色,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如下图所示:
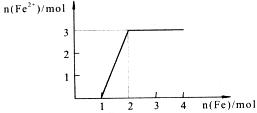
则稀溶液中HNO3和Fe(NO3)3的物质的量浓度之比为:
A.2:1 B.1:1 C.4:1 D.3:1
第Ⅱ卷(必做120分+选做32分,共152分)
[必做部分]
14.下列反应当温度降低时,反应(1)平衡向右移动,反应(2)平衡向左移动。
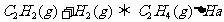 (1)
(1)
 (2)
(2)
据此判断以下3个热化学方程式中,





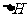 由大到小的正确顺序是
由大到小的正确顺序是
A. 、
、 、
、 、 B.
、 B. 、
、 、
、
C. 、
、 、
、 D.
D. 、
、 、
、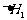
13.一定温度下,用水稀释0.1 mol.L-1的稀醋酸,若用KWw表示水的离子积,K电离表示醋酸
的电离常数,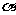 表示醋酸的电离度。则下列数值随水量的增加而增大的是
表示醋酸的电离度。则下列数值随水量的增加而增大的是
A.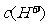 B.
B.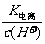 C.
C.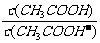 D.
D.
12.在短周期元素中,甲元素与乙、丙、丁三元素紧密相邻(上下左右均可能)。四种元素原
子的最外层电子数之和为24,甲、乙两元素的原子序数之和比丙元素的原子序数多1。下
列说法正确的是
A.气态氢化物的稳定性乙大于丙
B.丁是同周期中原子半径最小的元素
C.同浓度的最高价含氧酸溶液的pH丁小于丙
D.元素甲和丙形成的两种常见化合物均为强还原剂
11.通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之 c对F列实验
事实的解释正确的是
|
|
现象 |
解释 |
|
A |
KI淀粉溶液中通入Cl2,溶液变蓝 |
Cl2能与淀粉发生显色反应 |
|
B |
浓HNO3在光照条件下变黄 |
浓HNO3不稳定,生成有色产物能溶于浓硝酸 |
|
C |
某溶液中加入硝酸酸化的氯化钡溶 液,有白色沉淀生成 |
说明该溶液中含有SO42- |
|
D |
铜片放入浓硫酸中,无明显变化 |
说明铜在冷的浓硫酸中发生钝化 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com