
13.将过量的CO2分别通入:①CaCl2溶液 ②Na2SiO2溶液 ③Ca(ClO)2溶液 ④饱和Na2CO3溶液 ⑤NaAlO2溶液。最终有沉淀生成的
A.②④⑤ B.②③⑤ C.②⑤ D.①②③④⑤
11.以下说法正确的是
A.非金属元素的原子间只形成共价键,金属元素的原子和非金属元素的原子间只形成离子键。
B.原子间必须通过电子得失或形成共用电子对而形成化学键,而与原子核无关。
C.原子是化学变化中的最小微粒,即化学变化不产生新元素。核反应产生了新元素不为化学变化。
D.原子晶体的原子间只存在共价键,而形成分子晶体的原子间均存在范德华力。
|
|
B.生成的氢化物分子间均可形成氢键
 C.A与C形成的阴离子可能有AC
C.A与C形成的阴离子可能有AC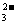 、A2C
、A2C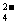
D.A、B、C、D的单质常温下均不导电
10.关于氢键,下列说法正确的是
A.在水中,每个氧原子周围有4个氢原子,并分别与之形成氢键
B.甲硫醇(CH3SH)比甲醇的熔点低的原因是甲醇分子间易形成氢键
C.氨易液化与氨分子间存在氢键无关
D.水是一种非常稳定的化合物,这是由于水分子间存在氢键所致
9.将SO2通入CuSO4和NaCl的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀分析,知其中含Cl:35.7%,Cu:64.3%,SO2在上述反应中作用是
A.酸 B.漂白剂 C.氧化剂 D. 还原剂
8.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.常温常压下乙炔与1,3-丁二烯混合气ag,其中C-H键的数目约为aNA/13
B.将含有NO2和N2O4分子共约NA个的混合气,温度降至标准状况,其体积约为22.4L C.1 mol干冰晶体中含有C=O键的数目为2NA
D.1 molCa(ClO)2只作氧化剂且充分反应时,转移的电子数一定为2NA
7.将SO2通入BaCl2溶液至饱和,未见沉淀生成,继续通入另一种气体,仍无沉淀,则通入
的气体可能是
A.CO2 B.NH3 C.NO2 D.H2S
6.将甲、乙两种金属的性质相比较,已知①甲与H2O反应比乙与H2O反应剧烈;②甲单质能从乙的盐溶液中置换出单质乙;③甲的最高价氧化物的水化物碱性比乙的最高价氧化物的水化物碱性强;④与某非金属单质反应时甲原子得电子数目比乙的多;⑤甲单质的熔、沸点比乙的低。能说明甲的金属性比乙强的是
A.①④ B.③⑤ C.①②③ D.①②③④⑤
5.下列对物质用途的描述中,错误的是
A.漂粉精及明矾都可作自来水的消毒剂
B.二氧化硫可用来漂白纸浆、毛、丝等
C.重晶石常作X射线透视肠胃的“钡餐”
D.铝可用于冶炼某些熔点较高的金属
4.实验测得CO和O2混合气体的密度是氢气的14.5倍,其中氧气的质量分数是
A.25.0% B.27.6% C.72.4% D.75.0%
3.下列有关说法正确的是
A.CaCl2、聚苯乙烯、HD均为化合物
B.CH2O2、C3H6O2、C4H8O3一定互为同系物
C.明矾、冰醋酸、硫酸钡均为电解质
D.SiO2、NaCl、S8、Cu均能表示物质分子组成
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com