
7、某种药物主要成分X的分子结构如下:
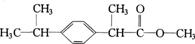
关于有机物X的说法中,错误的是 ( )
A.X难溶于水,易溶于有机溶剂 B.X能跟溴水反应
C. X能使酸性高锰酸钾溶液褪色 D.X的水解产物不能发生消去反应
6.北京大学和中国科学院的化学工作者合作已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子晶体,且有良好的超导性,下列K3C60的组成和结构的分析正确的是 ( )
A.K3C60中既有离子键 ,又有极性键 B.1molK3C60中含有的离子数目为63×6.02×1023
C.该晶体熔融状态下能导电 D.该物质的化学式可定为KC20
5、我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2 + NH3 + H2O + NaCl = NaHCO3↓+ NH4Cl的反应原理制备纯碱。下面是在实验室进行模拟实验的生产流程示意图:
气体A的饱和溶液加入食盐ⅠA和食盐的饱和溶液通入足量气体BⅡ悬浊液过滤Ⅲ晶体Ⅳ纯碱
则下列叙述错误的是
A.A气体是NH3,B气体是CO2
B.第Ⅲ步得到的晶体是发酵粉的主要成分
C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D.第Ⅳ步操作的主要过程有溶解、蒸发、结晶
4、下列离子在溶液中能大量共存,加入(NH4)2Fe(SO4)2·6H2O晶体后,仍能大量共存的是 ( )
A.Na+ 、H+ 、Cl- 、NO3- B.K+ 、Ba+ 、OH- 、I-
C.Na+、 Mg2+ 、Cl- 、SO42- D.Cu2+ 、 S2- 、Br- 、ClO-
3.已知1g氢气燃烧生成气态水时放出120.9kJ的热量,1 mol液态水变成1 mol水蒸气时吸收44 kJ的热量,则表示氢气燃烧热的热化学方程式为
A.H2(g)+ O2(g)=H2O(g);△H=-120.9kJ/mol
O2(g)=H2O(g);△H=-120.9kJ/mol
B.H2(g)+ O2(g)=H2O(l);△H=-285.8 kJ/mol
O2(g)=H2O(l);△H=-285.8 kJ/mol
C.H2(g)+ O2(g)=H2O(g);△H=-241.8kJ/mol
O2(g)=H2O(g);△H=-241.8kJ/mol
D.2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ/mol
2、将纯水加热至90℃,下列叙述正确的是: ( )
A. 水的离子积变大、pH变小、呈酸性 B. 水的离子积不变、pH不变、呈中性
C. 水的离子积变小、pH变大、呈碱性 D. 水的离子积变大、pH变小、呈中性
1.“在火星上找到水存在的证据”位居《Science》杂志评出的2004年10大科技突破之首。下列关于水的说法中错误的是
A.由于氢键的作用,使H2O的沸点及冰的密度出现反常
B.水是由极性键构成的极性分子
C.没有氢键,就没有生命,水是一切生命的基础
D.使用高效催化剂在较温和的条件下可使水分解,同时释放能量
28.(12分)为测定(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00mL,加热到120℃左右,使氨气全部逸出,测得有关实验数据如下(标准状况):
[ 已知:(NH4)2SO4和NH4HSO4分解温度均高于200℃ ]
|
实验序号 |
样品的质量(g) |
NaOH溶液的体积(ml) |
氨气的体积(L) |
|
Ⅰ |
7.4 |
40.00 |
1.68 |
|
Ⅱ |
14.8 |
40.00 |
2.24 |
|
Ⅲ |
22.2 |
40.00 |
1.12 |
|
Ⅳ |
37.0 |
40.00 |
0.00 |
(1)实验过程中发生的有关反应的离子方程式为: 。
(2)由I组数据直接推测:标准状况下3.7 g样品进行同样实验时,生成氨气的体积为 L。
(3)试计算该混合物中的(NH4)2SO4和NH4HSO4物质的量之比 。
(4)欲计算该NaOH溶液的物质的量浓度应选择第 组数据,由此求得NaOH溶液的物质的量浓
度为 。(2-3小题只填结果,不必写出计算过程,4小题要求写出计算过程)
27. (10分)向100mLBaCl2、AlCl3和FeCl3 的混合溶液A中逐滴加入Na2SO4和NaOH的混合溶液B,产
生沉淀的物质的量n和加入溶液B的体积关系如下图所示:

(1)加入B溶液110 mL时,溶液中的沉淀是 (填化学式或名称,下同),
溶液中的溶质是 。
(2)从90 mL至100mL之间加入10mL B溶液时发生的离子反应方程式是:
Ba2+ + SO42- = BaSO4↓ ,Al(OH)3 + OH- = AlO2- + 2H2O
则溶液B中Na2SO4与NaOH的物质的量浓度之比为 。
(3)将A、B溶液中各溶质的物质的量浓度填入下表:
|
溶 质 |
Na2SO4 |
NaOH |
BaCl2 |
AlCl3 |
FeCl3 |
|
浓度(mol•L-1) |
|
|
|
|
|
26.(11分)A-J是中学化学中常见的几种物质,它们之间的转化关系如下图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F化合生成,J可作禽流感、SARS等病毒的杀菌消毒剂。
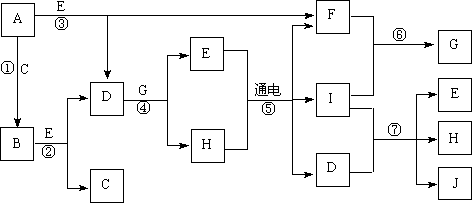
(1)写出E的电子式: 。
(2)写出反应⑦的离子方程式: 。
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式: 。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则阳极的电极反应式为: 。
__ 极(填“阴”或“阳”)附近溶液由无色变为红色,其原因是:
__
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com