
14、某离子X2+的最外层有2个电子,共有5个电子层,当把固体XCl2溶入水配成溶液时,需加少量的单质X和盐酸。由此得出判断,下列说法中不正确的是
A、X元素常见的化合价有+2价和+4价 B、XO2具有强氧化性
C、通常情况下X的+4价化合物比+2价化合物稳定 D、XCl2的水溶液显酸性
13、已知反应(1)2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2和反应(2)2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2 均可得到I2,下列有关说法正确的是
A、NaI 和NaIO3在一定条件下反应生成I2 B、氧化性:MnO2>IO3->I2>SO42->Mn2+
C、两个反应中生成等量的I2时转移的电子数相等
D、I2在反应⑴中是氧化产物,在反应⑵中是还原产物
12、Al(OH)3是一种难溶于水的物质,只要溶液中Al3+ 物质的量浓度(mol/L)和OH-物质的量浓度(mol/L)3次方的乘积大于1.9×10-33,就会析出Al(OH)3沉淀,则0.10mol/L AlCl3不产生沉淀的最大OH- 物质的量浓度(mol/L)为
A、1.9×10-33 B、2.7×10-11 C、8.7×10-8 D、1.2×10-11
11、下列各溶液中,微粒的物质的量浓度关系正确的是 ( )
A、10mL 0.5mol/L CH3COONa溶液与5mL 1mol/L盐酸混合:
c(Cl-)>c(Na+)>c(H+)>c(OH-)
B、0.1mol/L pH为4的NaHB溶液中: c(HB-)>c(B2-)>c(H2B)
C、在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D、c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2CO3]<c[(NH4)2SO4]<c(NH4Cl)
10、下列离子方程式书写正确的是
A、NaHSO3溶液显酸性是因为:HSO3-==SO32-+H+
B、四氧化三铁粉末溶于足量的稀HNO3:Fe3O4+8H+=2Fe2++Fe3++4H2O
C、电解饱和食盐水时阴极电极反应式为:2H++2e-==H2↑
D、1L2mol/L的FeBr2溶液中通入2.5molCl2:2Fe2++4Br-+3Cl2==6Cl-+2Fe3++2Br2
9、设No为阿伏加德罗常数的值,下列叙述中不正确的是
A、2.9g 2CaSO4·H2O含有的结晶水分子数为0.02No
B、12.4g白磷晶体中含有的P-P键数是0.6No
C、2mol SO2和1 mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2No D、100g的98%的浓H2SO4中所含的氧原子数为4No
8、X+、Y+、M2+、N2-均为含有一定数目电子的短周期元素的简单离子,离子半径大小关系:N2->Y+、Y+>X+、Y+>M2+,下列比较正确的是
A、原子半径:N可能比Y大,也可能比Y小 B、碱性:M(OH)2>YOH
C、M2+、N2-核外电子数:可能相等,也可能不等 D、原子序数:N>M>X>Y
7、零排放燃料电池曾被美国《时代》杂志列为21世纪改变人类生活的十大新科技之首。其中质子交换膜燃料电池的工作原理如右图所示,下列选项中不正确的是
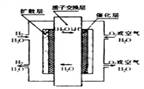 A、该电池的正极反应式为:O2+4H++4e-==2H2O
A、该电池的正极反应式为:O2+4H++4e-==2H2O
B、该电池的负极反应式为:2H2-4e-== 4H+
C、该电池的总反应式为:2H2+O2==2H2O
D、导电离子:H+(质子)由正极定向移动至负极
6、合成NH3的反应N2+3H2 2NH3,起始时的混合气体的平均分子的相对质量为8.5,于一定温度和压强下,反应达到平衡后混合气体的密度比起始时增加了1/4,(设反应前后温度压强不变)则反应中N2的转化率是
2NH3,起始时的混合气体的平均分子的相对质量为8.5,于一定温度和压强下,反应达到平衡后混合气体的密度比起始时增加了1/4,(设反应前后温度压强不变)则反应中N2的转化率是
A、20% B、30% C、40% D、50%
5、在100℃时,将pH=12的NaOH溶液V1 L与pH=l的H2SO4溶液V2 L混合,若所得混合溶液的pH=11,则V1∶V2为(已知:在100℃时,水的离子积为10-12)
A、2:9 B、101:9 C、9:2 D、9:101
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com