
23、(10分)《2004年江苏省环境状况公报》中指出:江苏省2004年工业(主要是热电厂)二氧化硫排放总量为1.24×106 t,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%,阳离子以铵根离子为主,约占阳离子总量的84.1%。阴离子中SO42-和NO3-的质量比为4.13∶1,NO3-的比例呈明显上升的趋势。
回答下列问题:
⑴江苏省大气污染特征是________________
A、煤烟型 B、机动车尾气型
C、由煤烟型向煤烟型与机动车尾气混合型转化
D、由机动车尾气型向煤烟型与机动车尾气混合型转化
⑵请你提出江苏省防治酸雨的两条主要措施____________________;______ ___。
⑶某校研究性学习小组拟选择“不同地点空气中二氧化硫的含量分析”的课题进行探究。
①如果你参加该课题的探究,在小组讨论测定地点时,你建议选择的测定地点分别是(至少三种不同类型)_________________________________________________________。
②通过查阅资料后发现,1994年以前,人们常采用HgCl2、NaCl的混合溶液吸收二氧化硫,1994年国家颁布标准(GB/T15262-94)规定用甲醛溶液吸收二氧化硫。变更吸收剂的原因除了用甲醛溶液的吸收效果比较好外,另一个原因可能是________________。
③甲醛溶液吸收二氧化硫以后发生了如下反应,生成稳定的羟基甲磺酸:
 HCHO+H2SO3→
HCHO+H2SO3→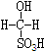 该反应类型属于__________。
该反应类型属于__________。
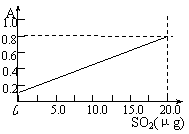
测定时,只需向吸收空气的甲醛吸收液中加入适量NaOH和指示剂,SO2与指示剂、甲醛反应生成可溶性紫红色化合物,根据溶液颜色深浅(用吸光度A表示,可由仪器进行测量),就能确定二氧化硫的含量。实验测得SO2含量与溶液的吸光度A的关系如右图所示。若欲测定某地空气中二氧化硫的含量(mg·m-3),除需要测定吸光度A外还需要记录的数据为____ ____,________ __________,_____________。
22、(10分)2005年的诺贝尔化学奖颁给了在烯烃复分解反应研究方面做出突出贡献的3位化学家。烯烃复分解反应实现了在一定条件下烯烃中碳碳双键两边基团的换位。
如:2CH2=CHCH2CH3
 CH2=CH2+CH3CH2CH=CHCH2CH3。
CH2=CH2+CH3CH2CH=CHCH2CH3。
又已知:两个醛分子在一定条件下可以发生加成反应:
现仅以丙烯为有机原料,经过下列反应可以分别合成重要的化工原料F和K,以F和K为原料可合成一种链状高分子化合物M,其化学组成为(C12H20O4)n。
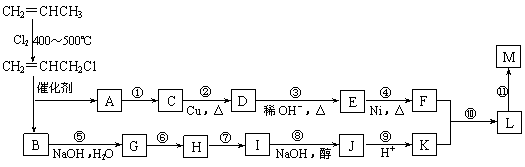
回答下列问题:
⑴反应①的反应类型是:_________________。
⑵反应⑥、⑦中有一反应是与HCl加成,该反应是_____(填反应编号),设计这一步反应的目的是_________________________。
⑶物质M的结构简式为:______________________________________。
⑷写出下列反应的化学方程式:
反应⑧:__________________________; 反应⑩:________________。
21、(10分)有机化合物A广泛存在于水果肉中,尤以苹果、葡萄、西瓜、山楂内为多。已知:
① A中碳和氢的质量分数之和为40.3%,其余为氧;其相对分子质量大于110,小于150。
② A与乙酸或丙醇在浓硫酸、加热的条件下生成有香味的产物;
③ 1molA与足量的钠最多能产生1.5 mol气体;
④ A在一定温度下脱水得到产物B(不是环状化合物),B可以和溴水发生加成反应。
试回答:
(1)A的分子式为 。
(2)对A的结构可作出的判断是 (多选扣分)。
(a)肯定有碳碳双键 (b)有两个羧基
(c)肯定有羟基 (d)有一COOR官能团
(3)有机物A的结构简式(不含一CH3)为 。
(4)A在一定温度下的消去产物为B,则B和溴水反应的化学方程式: 。
20、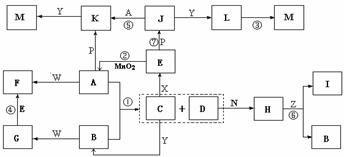 (10分)下图中,A为气体非金属单质,D是空气中含量最多的气体,B、E、Z为无色氢化物,其中B、E为有刺激性气味的气体,C是由三种短周期非金属元素组成的离子化合物,F、I、L为白色沉淀,其中F不溶于稀硝酸,N、P是金属单质;反应②在E的浓溶液中进行,反应⑦在E的稀溶液中进行,反应②、⑦均可用于实验室制取某种气体(图中部分反应物和生成物没有列出)。
(10分)下图中,A为气体非金属单质,D是空气中含量最多的气体,B、E、Z为无色氢化物,其中B、E为有刺激性气味的气体,C是由三种短周期非金属元素组成的离子化合物,F、I、L为白色沉淀,其中F不溶于稀硝酸,N、P是金属单质;反应②在E的浓溶液中进行,反应⑦在E的稀溶液中进行,反应②、⑦均可用于实验室制取某种气体(图中部分反应物和生成物没有列出)。
请按要求回答:
⑴写出C的电子式 ,I的化学式 ;
⑵反应③的化学方程式为 ;
⑶反应④的离子方程式为 ;
⑷由C制取E时反应物的状态是 ,由J制取L时反应的环境是 。
19、 (8分)我国是最早记载丹砂的药用价值和炼制方法的,为了使人们重视丹砂,1982年我国发行面值为10分的丹砂邮票。汞单质和化合物在工业生产和科学研究上有其广泛用途。丹砂炼汞的反应包括以下两个反应:反应Ⅰ HgS +O2 Hg +SO2
(8分)我国是最早记载丹砂的药用价值和炼制方法的,为了使人们重视丹砂,1982年我国发行面值为10分的丹砂邮票。汞单质和化合物在工业生产和科学研究上有其广泛用途。丹砂炼汞的反应包括以下两个反应:反应Ⅰ HgS +O2 Hg +SO2
反应Ⅱ 4HgS +4CaO 4Hg +3CaS + CaSO4
请试完成下列问题:
(1)HgS与氧气反应,氧化剂是 。
(2)请标出反应Ⅱ中电子转移的方向和数目。
(3)得到的汞中含有铜等杂质,工业上常用5%的硝酸洗涤,写出除去少量铜杂质反应的离子方程式: 。
(4)已知Hg(NO3)2溶液中加入Hg,存在如下平衡:Hg + Hg2+  Hg22+
,提高Hg22+浓度的方法是:
。
Hg22+
,提高Hg22+浓度的方法是:
。
甲:将锌放入浓盐酸中,反应速率较快
乙:将实验过程记录下来,并交流。

根据上述资料与交流材料回答下列列问题
⑴乙反应速率明显比甲快,原因是: 。
⑵丙、丁根据铜位于金属活动顺序表氢之后,与盐酸不反应,对乙产生的气体体积比甲大的事实。作出如下推断:
①丙认为是溶解在溶液中的H2逸出,你认为是否有道理,理由是: 。
②丁作了如下猜想,是否成立,请你设计实验方案。
|
丁猜想 |
验证方法 |
预测现象及结论 |
|
丁认为铜片中可能含有锌等杂质 |
|
|
⑶戊注意到乙中(3)中的白色沉淀,分析:不可能是CuCl2,因为CuCl2溶液显蓝色或绿色,也不可能是氯化锌,因为稀释后溶液更稀,不会析出。并利用资料①②大胆猜想,白色沉淀是生成的氯化亚铜。请你帮他设计验证方案(若有多个只设计两个方案):
|
戊 |
预计验证方法 |
预测的现象与结论 |
|
白色沉淀是氯化亚铜 |
|
|
|
|
|
⑷指导老师肯定了戊的猜想,请结合资料③,写出铜与足量浓盐酸在加热条件下反应生成无色溶液及气体,化学方程式可能是: 。
乙的实验步骤(3)稀释,生成沉淀,实际上是一个平衡问题,请写出这一平衡关系:
(用离子方程式表示)。
⑸就铜与浓盐酸反应若进一步探讨,你认为下一步实验方案: 。
18、(14分)某研究性学习小组在探究铜锌与浓盐酸反应,设计了如下实验方案
17、(10分)试完成下列两小题
(1)(4分)化学实验必须注意安全,下列做法存在安全隐患的是 (选填序号)。
A、氢气还原氧化铜实验中,先加热氧化铜后通氢气
B、蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拨开橡皮塞并投入碎瓷片
C、实验室做钠的实验时,余下的钠屑投入到废液缸中
D、配制浓硫酸与酒精混合液时,将1体积的酒精倒入3体积的浓硫酸中
E、皮肤上沾有少量浓硫酸时,立刻用大量水冲洗,再涂上稀碳酸氢钠溶液
F、制乙烯时,用量程为300℃的温度计代替量程为200℃的温度计,测反应液的温度
(2)(8分)在进行研究性学习的过程中,某同学把AgNO3溶液滴入K2HPO4溶液,即得黄色沉淀。经过查阅资料得知:K2HPO4溶液呈碱性;Ag2HPO4和Ag3PO4均为黄色沉淀,只是Ag2HPO4的颜色略浅。该同学认为不能简单地根据颜色的深浅,来确定沉淀是何物。为此,他设计了一个分析实验的方案:先测K2HPO4溶液的pH值;在K2HPO4溶液中滴加硝酸银溶液的同时,不断测定溶液的pH值,直到沉淀量达到最大为止。实际实验中,随着AgNO3溶液的滴入,溶液的pH最终为3-4之间。
①请你判断沉淀量达到最大值时的黄色沉淀是_____。(填“Ag3PO4”或“Ag2HPO4”)
②根据上述实验结果,请写出K2HPO4 与AgNO3的化学方程式 ______。
③请你写出该实验的分析方案中是怎样得出实验结果的:__________________________。
16、石灰氮是由Ca、N、C等三种元素组成的盐,其含钙、碳的质量分数分别为50%、15%。(1) 石灰氮完全水解反应的产物是A和B,其中B可方便地制成一种氮肥。(2)A在高温下分解生成C和D,通常状况下,C为气体。(3)B的催化氧化产物为E和F;(4)E遇到D生成唯一产物G,G与C反应重新生成A和E.(5)F再被氧气氧化后的产物遇到E可以制备常用的一种强酸H;(6) B、C、E混合反应生成一种常用的氮肥I。以下有关叙述中正确的是
A、石灰氮是化学式为Ca(CN)2 B、(2)、(5)、(6)为有关工业生产过程的反应原理
C、1molB经过催化氧化生成E和F的过程中有3 mol电子发生转移
D、足量B和C与饱和氯化钠溶液反应可以制得发酵粉的主要成分之一
第Ⅱ卷(非选择题,共86分)
15、将4.9克Mg和Fe的混合物,溶解在过量的稀HNO3溶液中,完全反应得到标况下气体VL,再向反应后的溶液中加入足量的烧碱,得到沉淀的质量是10g (不考虑Fe(OH)2的转化),则气体体积是
A、1.12L B、2.24L C、3.36L D、4.48L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com