
21.(9分)某待测液中的阳离子可能含有K+、Fe3+、Ag+、Al3+、Ba2+、Ca2+、Mg2+等。进行下述实验(所加试剂均过量):

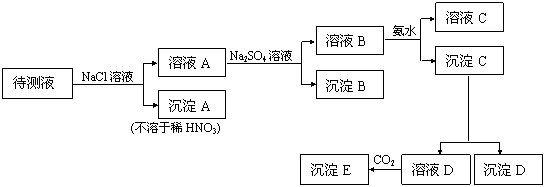

根据实验结果,填写下列空白:
⑴ 能确定存在的阳离子有 ,可能存在的阴离子有 ;
⑵ 若要证明K+的存在,还需进行的试验是 ;
⑶ 若要说明Mg2+存在,必须说明的现象是 ;
⑷ 从溶液D生成沉淀E的离子方程式是 。
20.(8分)已知X、Y、Z、W均为短周期元素,其原子序数依次增大。X和Y可形成常见化合物YX4,一个YX4分子中共有10个电子;Z单质在通常状况下为无色无味气体;W原子的最外层电子数是核外电子总数的3/4。试回答:
(1)由X、Z、W三种元素可组成一种盐,该盐是常用的速效化肥,不宜与碱性肥料混合或在碱性土壤中施用,其原因是_________________________________。
(2)由X、Y、Z、W四种元素可组成多种化合物,其中既能与盐酸又能与烧碱溶液反应的无机物是______________,有机物是___________________(各写一种)。
(3)将1.2 gY单质在足量W单质中燃烧所得的气体通入150 mL 1mol·L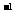 NaOH溶液中,完全反应后溶液中离子浓度由大到小的顺序是____________________。
NaOH溶液中,完全反应后溶液中离子浓度由大到小的顺序是____________________。
19.(6分)NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:
 NaNO2
+ HI
NO + I2 + NaI + H2O
NaNO2
+ HI
NO + I2 + NaI + H2O
(1)配平并标出电子转移的方向和数目。
(2)上述反应中氧化剂是 ,若有1 mol的还原剂被氧化,则参加反应的氧化剂物质的量是 mol。
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:① 水 ② 碘化钾淀粉试纸 ③ 淀粉 ④ 白酒 ⑤ 食醋,进行实验,下列几组合适的是 (填序号)。
A.③ ⑤ B.① ② ④ C.① ② ⑤
18.(8分)下图是教师在课堂中演示的两个实验装置(铁架台等辅助仪器略去未画)。
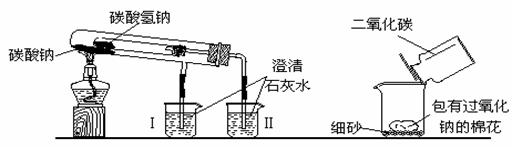
实验一 实验二
回答下列问题:
①实验一的实验目的是 ,
实验过程中可以看到烧杯中的实验现象是 ,
②实验二用来验证Na2O2与CO2的反应,观察到的实验现象是:包有Na2O2的棉花燃烧。从该实验可以得出许多结论,请你写出由该实验得出的两个结论。
结论1: ;
结论2: 。
17.(9分)(1) 下列有关实验操作或判断不正确的是 ____(填写序号,选错倒扣分)。
A.用10 mL量筒量取稀硫酸溶液 8.0 mL
B.用干燥的pH试纸测定氯水的pH
C.用碱式滴定管量取KMnO4溶液 19.60 mL
D.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏大
E.圆底烧瓶、锥形瓶、蒸发皿加热时都应垫在石棉网上
(2)被称为“魔棒”的荧光棒已成为节日之夜青少年的喜爱之物,其发光原理是利用过氧化氢氧化草酸酯产生能量,该能量被传递给荧光物质后便发出荧光.回答下列问题:
①有人说,发光的魔棒不能凑近石油气之类的可燃性气体,否则会导致爆炸,是否正确?说明理由。 。
②通过挤压,使过氧化氢与草酸酯混合反应,导致魔棒发光,一段时间后,光的亮度降低,此时,把魔棒往手心上敲打几下,亮度会重新增大,原因是什么?(提示:草酸酯是一种有较高粘度的有机化合物) 。
③在设计魔棒时,其连续发光的能力在8-12h,如果在发光中途,把它放入冰箱的冷冻室中,发光便会停止或基本停止.把魔棒从冷冻室中取出静止一会儿,它又会连续发光,原因是什么? 。
16、质量分数相等的碳酸钠、碳酸氢钠混合物x g,加热一段时间后,质量变为 y g ,当y为何值时,表明碳酸氢钠完全分解
A.x B.x C.x D. x
第Ⅱ卷(非选择题 共86分)
15、已知,同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS >H2S >CuS,则以下离子方程式错误的是
A.Mg2+ + 2 HCO3- + 2Ca2+ + 4 OH- = Mg(OH)2↓ + 2CaCO3↓ + 2H2O
B.Cu2+ + H2S = CuS↓ + 2H+
C.Zn2+ + S2- + 2H2O = Zn(OH) 2↓ + H2S↑
D.Fe2+ + H2S = FeS↓ + 2H+
14. 短周期元素A、B、C、D的原子序数依次增大,它们的原子最外层电子数之和为17,其中A、C同主族,B原子的最外层电子数等于A原子的次外层电子数,则下列叙述不正确的是
A.B与D可形成离子化合物
B.原子半径:B>C>D
C.由A形成的化合物种类繁多,结构复杂
D.最高价氧化物对应的水化物的酸性:A<C<D
13.在下列叙述中,不能说明硫酸的酸性比醋酸强的是
A.物质的量浓度相同的硫酸和醋酸稀释成pH=5的溶液,硫酸所需稀释的倍数多
B.用NaOH中和等体积等物质的量浓度的硫酸和醋酸,硫酸耗NaOH多
C.相同pH的硫酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH变化大
D.相同pH值的硫酸和醋酸中分别加等质量的锌,醋酸中锌先完全溶解
12.下列各种情况下,溶液中可能大量存在的离子组是
A.使pH试纸呈红色的溶液中:K+、Fe2+、NO3-、MnO4-
B.碱性溶液中:K+、Na+、SO32-、S2-
C.含有AlO2- 溶液中:K+、Ba2+、OH-、NO3-
D.由水电离出的c(H+)=l×10-13 mol·L-1 的溶液中:NH4+、Cl-、CO32--、Na+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com