
4、据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生的化学方程式为: 5KClO3 + 6P== 3P2O5 + 5KCl ,则下列有关叙述错误的是
A、上述反应中氧化剂和还原剂的物质的量之比为5:6
B、产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾)
C、上述反应中消耗3molP时,转移电子的物质的量为15mol
D、因红磷和白磷互为同分异构体,所以上述火药中的红磷可以用白磷代替
3、关于某溶液所含离子检验的方法和结论正确的是
A、加入过量NaOH溶液,有白色沉淀生成,则原溶液一定有Mg2+
B、加入AgNO3溶液有白色沉淀生成,加稀盐酸沉淀不消失,则原溶液一定有Cl-
C、加入盐酸产生能使澄清石灰水变浑浊的气体,则原溶液中可能有
CO32-或SO32-
D、加入NaOH并加热,产生使湿润的蓝色石蕊试纸变红的气体,则原溶液是铵盐溶液
2、下列有关说法不符合事实的是
A、同温同压下,气体的体积取决于气体的物质的量的多少
B、元素的相对原子质量取决于该元素各核素的相对原子质量和在自然界中的原子百分比
C、氯化钠投入到酒精中将形成胶体
D、氧化剂的氧化性强弱取决于该氧化剂中某元素化合价的高低
1、2006年9月21日,美国亚特兰蒂斯号航天飞机在爱德华空军基地安全着落,航天飞机表层的防热瓦曾成为航天飞机能否安全着落的制约因素。防热瓦是以石墨材料为主要成分的非常疏松的泡沫陶瓷。下列有关说法合理的是
A、石墨成为该泡沫陶瓷主要成分的主要原因是石墨是原子晶体
B、石墨成为该泡沫陶瓷主要成分的主要原因是石墨熔点很高
C、石墨中碳碳键之间的夹角为109°28'
D、C60也可代替石墨用作航天飞机表层的防热瓦材料
27、(10分)如下介绍:在氢氧化钠浓溶液中加入氧化钙,加热,制成的白色固体就是碱石灰。有两个实验小组的同学决定通过实验探究碱石灰的组成。
(1)第一小组设计的实验方案如下
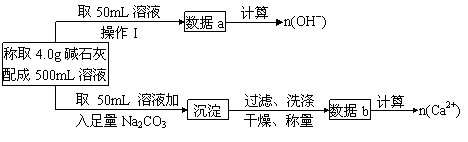

①下列关于溶液中n(Na+)的计算式中正确的是________。(填序号)
a.n(Na+) = n(OH-) - 2n(Ca2+) b.n(Na+) = [n(OH-)- n(Ca2+)]/2
c.n(Na+) = 2n(OH-)- n(Ca2+)
②现有4.0g碱石灰,设其中n(OH-)=x mol,n(Ca2+)=y mol,请填写下表:
|
碱石灰的 可能组成 |
NaOH,CaO |
NaOH,CaO , Ca(OH)2 |
NaOH,Ca(OH)2 |
NaOH, Ca(OH)2,H2O |
|
x、y之间关系式(等式或不等式) |
|
40x-24y<4.0<40x-6y |
|
|
(2)第二小组查得如下资料:氢氧化钙在250℃时不分解,氢氧化钠在580℃时不分解。他们设计了如下方案并得出相关数据:取市售碱石灰4.0g,在250℃时加热至恒重,测得固体质量减少了0.6g,剩余固体在580℃时继续加热至恒重,固体质量又减少了0.7g 。请通过计算确定该碱石灰各成分的质量分数。
26、(8分)有硫酸钠和碳酸镁的混合物,用40mL 盐酸完全溶解后,在标准状况下收集到0.448L二氧化碳。向反应后的溶液中加入含有0.025mol氢氧化钡的溶液,可得到5.82g沉淀,此时溶液的pH=12,体积为200mL。试求:
(1)原混合物中MgCO3的质量
(2)得到的沉淀中硫酸钡的质量
(3)盐酸的物质的量浓度
25.(8分)化合物A由C、H、O、N 4种元素组成,M<300,其中ω(N)=4.81%,
m(C)∶m(O)=3∶1。A在酸性溶液中水解生成B和C。
回答下列问题: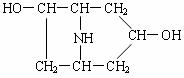
⑴ A的分子式为 ;
⑵ 若B的结构如右图所示,C分子中有一个甲基,是芳香族化合物,其苯环上只有1个取代基。1molC能与2molNa反应生成1molH2,但1molC只能中和1molNaOH。则A可能的结构有2种,请写出其中1种 ;
⑶ 物质C有多种同分异构体,请按要求写出其中两种:
① 能使FeCl3溶液显色,也能使紫色石蕊试液显红色;分子内有1个乙基,苯环上取代基均处于间位: ;
② 既能发生水解反应,又能发生银镜反应;不能使FeCl3溶液显色,但能和Na反应生成H2,分子内无甲基且苯环上的一氯取代物有2种: 。
24.(4分)某有机物含有C、H、O、N四种元素,下图为该有机物的球棍模型。
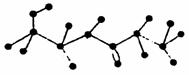 (1)该有机物的结构简式为________________。
(1)该有机物的结构简式为________________。
(2)该有机物不可能发生的化学反应有________
(填序号)。
①水解 ②加聚 ③取代
④消去 ⑤酯化 ⑥缩聚
23.“室内空气污染”是影响人们身体健康的重要原因。造成室内空气污染的有毒物质主要有甲醛、苯、氨、氡四种。甲醛主要存在于人造板材、复合地板、涂料中;苯是直接致癌物,污染源主要有油气、胶、内墙涂料、防水材料;氨主要是存在于混凝土墙体、防冻液中;用来染发的物质都含有大量的氨。氡是自然界唯一的天然放射性稀有气体,无色无味,最难以察觉。氡是导致人类除吸烟以外引起肺癌的第二大因素,世界卫生组织(WHO)把它列为使人致癌的19种物质之一,洁具、石材多含有氡。回答下列问题:
⑴ 小陈同学家刚买了一套新房并进行了装修。在小陈同学家搬进新居前,出于对小陈同学健康的关心,请你对小陈同学提两点建议: , ;
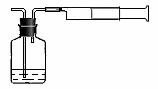 ⑵我国《室内空气质量标准》规定室内空气中甲醛含量不得超过0.08mg·m-3。小陈同学为测定新居内空气中甲醛含量是否超标,设计了如图所示的简易实验装置:
⑵我国《室内空气质量标准》规定室内空气中甲醛含量不得超过0.08mg·m-3。小陈同学为测定新居内空气中甲醛含量是否超标,设计了如图所示的简易实验装置:
① 如果你帮助小陈同学检查该装置的气密性,你操作的方法是 ;
② 请你帮助小陈同学选择装置中试剂瓶内的药品: (填序号);
a.稀银氨溶液 b.稀酸性高锰酸钾溶液 c.新制得氢氧化铜悬浊液
③ 在检查好装置气密性和选择好试剂瓶内的药品后,请你帮助小陈同学完成该实验的操作 ;
④ 若试剂瓶内溶液的体积和浓度已知,注射器容积为100 mL,实验时还需知道的数据有 ,为了保证数据的科学性,还需注意的问题是 。
22.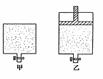 (6分) 有甲、乙两个密闭容器,如图所示,甲容器能保持容积恒定,乙容器能保持压强恒定:
(6分) 有甲、乙两个密闭容器,如图所示,甲容器能保持容积恒定,乙容器能保持压强恒定:
(1)在甲容器中加入2mol三氧化硫和1mol N2,乙容器中加入2mol二氧化硫和1mol氧气,起始时容积相同,在相同的温度下(500℃)反应均达平衡。则两容器内压强甲________乙,(填大于、小于或等于,下同);容器内混合气体的平均相对分子质量甲______乙。
(2)若在两个容器中,甲中加入2mol三氧化硫,乙中加入4mol三氧化硫,起始时两容器内的温度和压强均相同,反应过程中,温度保持一定。若达平衡后,甲容器内三氧化硫的物质的量为a mol,则乙容器中三氧化硫的物质的量__________2a mol。(填,大于、小于或等于)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com