
3.已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化
H2O2 → H2O IO3- → I2 MnO4- → Mn2+ HNO3 → NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A. H2O2 B. IO3- C. MnO4- D. HNO3
2.Na3N是离子化合物,它能与水反应生成氨气。以下关于Na3N的说法中正确的是( )
A.Na3N与盐酸反应时生成两种盐
B.在Na3N与水反应中Na3N是还原剂
C.Na3N分子中Na+的半径比N3-的半径大
D.Na+ 与 N3-的电子层都与氩原子的结构相同
1. 下列各项中的“黄色”,不属于因化学反应而产生的现象的是( )
A.无色试剂瓶中的浓硝酸呈黄色
B.用玻璃片靠近在玻璃导管口燃着的硫化氢的火焰,玻璃片上附有的固体呈现黄色
C.久置的碘化钾溶液呈黄色
D.食盐在无色的火焰上灼烧时,火焰呈黄色
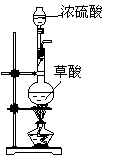
21(10分)、现有废液,其中含有CuCl2、FeCl2、HCl。某课外活动小组计划用它得到纯净的FeCl2晶体。为此设计如下实验方案:
|
序号 |
A |
B |
C |
D |
E |
|
仪器及药品 |
 |
 |
 |
 |
 |
第一步:用上图中的仪器和药品组装一套实验装置制取干燥的CO,用CO还原Fe2O3粉末制取还原铁粉。
(制取CO的原理为:H2C2O4 CO2↑+CO↑+H2O)
CO2↑+CO↑+H2O)
(1)如果所制气体流向从左向右时,上述组装的实验装置从左向右的实验装置连接顺序(填仪器序号)是 → → → → 。
(2)正确的操作第一步应是 ;最后一步应是
熄灭 处的酒精灯。
(3)装置B的作用是 ;装置E的作用
是 。
第二步 :将制得的还原铁粉放入原混合溶液中,制得纯净的FeCl2溶液。
(4)必须进行的操作是 。
第三步:得到纯净的FeCl2晶体。
(5)必须进行的操作是 。
22(10分)、工业上用饱和食盐水作原料,用电解方法制取烧碱。 (1)写出电极反应和总化学方程式:阳极______________________,阴极_________________________;总反应________________________。 (2)NaOH在_________极附近生成; (3)电极材料为石墨和铁网,阳极必须用_________,原因是
___________________________________________; (4)电解过程中可能发生的副反应有两个,它们是: ______________________________________,
(5)若将电解槽内的隔膜去掉,同时升高电解液的温度,此时电解产物间发生反应:NaOH+Cl2→NaClO3+NaC1+H2O(未配平),假设反应进行完全,则在该条件下最后得到的两种产物的物质的量之比是______________
(6)若在NaClO3溶液中加入固体KCl,则可得到重要工业产品KClO3晶体,其原因是_______________________________________________。
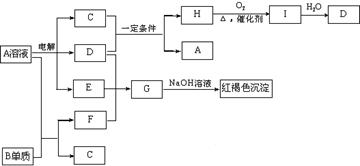
23(10分)、如下图所示,A溶液呈蓝色。(图中参加反应的水及生成的水已略去)
 请回答下列问题:
(1)写出电解A溶液的离子方程式:
;
(2)写出C和D在一定条件下反应的化学方程式:
;
(3)写出G的化学式:
;
(4)若欲将A溶液与B单质反应的化学能转化为电能,则所设计的原电池的正极材料可以是:
;负极的反应式是:
。
24(10分)、取0.04molKMnO4固体,加热一段时间后将剩余固体与浓盐酸共热,收集到气体 V(L)(标准状况)。若KMnO4的分解率为x ,HCl挥发忽略不计,与盐酸反应后Mn元素全部以Mn2+存在,则:
请回答下列问题:
(1)写出电解A溶液的离子方程式:
;
(2)写出C和D在一定条件下反应的化学方程式:
;
(3)写出G的化学式:
;
(4)若欲将A溶液与B单质反应的化学能转化为电能,则所设计的原电池的正极材料可以是:
;负极的反应式是:
。
24(10分)、取0.04molKMnO4固体,加热一段时间后将剩余固体与浓盐酸共热,收集到气体 V(L)(标准状况)。若KMnO4的分解率为x ,HCl挥发忽略不计,与盐酸反应后Mn元素全部以Mn2+存在,则:
(1)V= L(用含x的代数式表示)。
(2)当x= 时,V的值最水,其值为 L。
(3)当V=2.016L时,第一次加热所得固体的质量为 g。
20、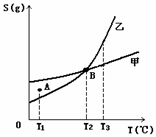 甲、乙两种物质溶解度曲线如右图所示:下列说法一定正确的是
甲、乙两种物质溶解度曲线如右图所示:下列说法一定正确的是
A、A点表示T1℃时甲的溶液已饱和,乙的溶液未饱和
B、B点表示T2℃时甲、乙两物质的溶液均达饱和且两溶液的物
质的量浓度相等
C、将T3℃时甲、乙两物质的饱和溶液分别降温至T2℃,析出的
乙比析出的甲多
D、若乙中含有少量的甲,可用重结晶的方法提纯乙
第І卷 (非选择题,共40分
19、已知在1×105 Pa,298 K条件下,2 mol氢气燃烧生成水蒸气放出484 KJ热量,下列热化学方程式正确的是 ( )
A. H2O(g) == H2(g)+1/2 O2(g); △H1=+242 kJ·mol-1
B. 2 H2(g)+ O2(g)===2 H2O(l); △H2=- 484 kJ·mol-1
C. H2(g)+1/2 O2(g)====H2O(g) ; △H1=+242 kJ·mol-1
D. 2 H2(g)+ O2(g)===2 H2O(g); △H2=+484 kJ·mol-1
18、已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液形成无色溶液,其化学方程式是PbSO4+2CH3COONH4== (CH3COO)2 Pb +(NH4)2SO4。当在(CH3COO)2 Pb(醋酸铅)溶液中通入H2S时,有黑色沉淀PbS生成,表示这个反应的有关离子方程式是( )
A.(CH3COO)2 Pb +H2S==PbS↓+2 CH3COOH
B.Pb2++H2S==PbS↓+2H+
C.Pb2++2CH3COO-+H2S== PbS ↓+2 CH3COOH
D.Pb2++2 CH3COO- + 2H+ + S2-== PbS↓+2 CH3COOH
17、以NA表示阿佛加德罗常数,下列说法中正确的是
A 53g碳酸钠中含NA个CO32-
B 0.1molOH-含NA个电子
C 1.8g重水(D2O)中含NA个中子
D 标准状况下11.2L臭氧中含NA个氧原子
16、在反应 aBrF3 + bH2O == cHBrO3 + dHBr + eHF + fO2 (a、b、c、d、e、f是各物质的化学计量数),若0.3mol H2O被氧化,则被水还原的BrF3的物质的量是
A.0.15mol B.0.2mol C. 0.3mol D.0.4mol
15、某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标/mol·L-1)和加入铁粉的物质的量(横坐标/mol)之间的关系如图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为:
 A.1∶1∶1 B.1∶3∶1
A.1∶1∶1 B.1∶3∶1
C.3∶3∶8 D.1∶1∶4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com