
6.清晨,松树林中的空气格外清新,是因为有极少量的氧气能够变成臭氧,反应的化学方程式为:3O2=====2O3。下列有关该反应的说法正确的是 ( )
A.这是一个氧化还原反应 B.臭氧与氧气是氧的同素异形体
C.臭氧与氧气是氧的同位素 D.产生的臭氧可以填充“臭氧空洞”
22. (9分)现在由等物质的量的NaHCO3和KHCO3组成的混合物a g,与100mL盐酸反应。(题中涉及的气体体积均以标准状况计,填空时可以用带字母的式子表示。)
(1)如碳酸氢盐与盐酸恰好完全反应,则盐酸的物质的量浓度为 mol·L-1。
(2)如果盐酸过量,生成CO2的体积为 L。
(3)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需要知道 。
(4)若NaHCO3和KHCO3不是以等物质的量混合,则a g固体混合物与足量的盐酸完全反应时生成CO2的体积(VCO2)范围是 。(不要求写计算过程)
21. (4分)将15.6 g Na2O2溶于b g水中,恰好使Na+离子数与水分子数之比为1:50,则b值为多少?(请写出详细计算过程)
20.(12分)X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系
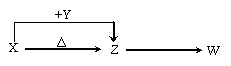 (部分反应物、产物及反应条件已略去)。请回答:
(部分反应物、产物及反应条件已略去)。请回答:
(1)W的电子式是 。(2)X与Y在溶液中反应的离子方程式是 。
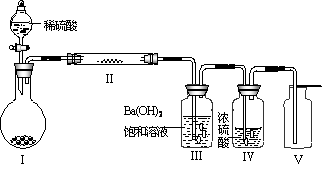 (3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用右图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置V中可收集到一种无色气体。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用右图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置V中可收集到一种无色气体。
①装置Ⅰ中反应的化学方程式是 。
装置Ⅱ中物质的化学式是 。
②用Ⅹ含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是 ,所需仪器装置是 (从上图选择必要的装置,填写编号)。
19.(16分)中学化学中几种常见物质的转化关系如下:
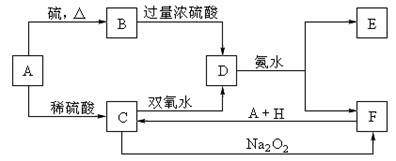
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体E粒子直径大小的范围: 。
(2)A、B、H的化学式:A ,B ,H 。
(3)①H2O2分子的电子式:
②写出C的酸性溶液与双氧水反应的离子方程式: 。
(4)写出鉴定E中阳离子的实验方法和现象:
(5)在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式: 。
18.(8分) 碱金属能形成离子型氢化物。如氢化钠的化学式为NaH,氢化钠具有较强的还原性。
(1)氢化钠的电子式为____________,氢化钠中氢元素是______价。
(2)NaH能与水剧烈反应生成对应的碱和氢气,写出反应的化学方程式并标明电子转移的方向和数目_______ ____。该反应中氧化产物与还原产物的质量比为______________。
17. 天平的两个托盘上放两个等质量的烧杯,分别加入3.65 g的盐酸,再分别加入x g的NaHCO3与y g的KHCO3, 反应后天平仍平衡,则x,y的正确关系是( )
A. x>y≥8.4 g B. y>x≥10 g C. x=y≥8.4 g D. x=y≥10 g
第Ⅱ卷(非选择题,共49分)
16.将一定量的钠、铝合金置于水中,合金全部溶解,得到20ml、pH=14的溶液,然后用1mol/L的盐酸滴定至沉淀量最大时,消耗盐酸40ml。原合金中钠的质量为( )
A.0.23g B. 0.64g C.0.69g D. 0.92g
15.有一在空气中暴露过的KOH固体,经分析知其内含水7.62%、K2CO3 2.38%,KOH 90%,若将样品1g加入到1mol·L-1盐酸46mL里,过量的酸再用1.07mol·L-1 KOH溶液中和,蒸发中和后的溶液可得固体质量为( )
A.3.43g B.4.00g C.4.50g D.无法计算
14.下列条件下,两瓶气体所含原子数一定相等的是( )
A.同质量、不同密度的N2和CO2 B.同温度、同体积的H2和N2
C.同体积、同密度的C2H4和C3H6 D.同压强、同体积的N2O和CO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com