
7.下列实验事实不能证明醋酸是弱酸的是 ( )
A.常温下,测得醋酸钠溶液的pH>7
B.常温下,测得0.1mol/L醋酸溶液的pH=4
C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4
D.常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和

6.下列有关实验的叙述正确的是 ( )
A.少量液溴、白磷和金属钠的保存均需用水封
B.容量瓶、滴定管在使用前均需用所装试剂润洗
C.苯和甲苯、乙醇和乙酸均可使用分液漏斗分离
D.除去氯化钠固体中的碘、除去碳酸钠固体中的碳酸氢钠,均可用加热的方法
5.下列说法不符合人与自然和谐相处的是 ( )
A.对农作物合理施用化肥 B.将塑料垃圾埋入地下或倾倒入海
C.对废旧电池进行回收处理 D.使用沼气、太阳能、风能等代替煤炭
2007.4
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷两部分,满分300分. 考试时间150分钟。
第Ⅱ卷各小题用钢笔或圆珠笔将答案直接写在试题卷上。
第Ⅰ卷(选择题 共120分)
本卷共20小题,每小题6分,共120分。在每小题的四个选项中,选出符合题目要求的一项。
可能用到的相对原子质量是:H 1 C 12 N 14 O 16 Mg 24 Al 27 S 32
Cl 35.5 Fe 56 Ag 108 Ba 137
28.(14分)铝是一种重要的金属。
(1)铝在元素周期表中的位置是 。
(2)生产中曾用铝热反应焊接钢轨,铝与氧化铁发生反应的化学方程式为 。
(3)铝与NaOH溶液反应的离子方程式为 ;同温同压下,在浓度和体积均为100mL 2mol/L的盐酸及NaOH溶液中各加入等质量和Al,产生气体的体积比为5:6,则所加Al的质量为 。
(4)以上述所得AlCl3溶液为原料制取无水AlCl3,先制得AlCl3·6H2O晶体,主要操作包括 ,在干燥的HCl气流中加热AlCl3·6H2O晶体,能进一步制取无水AlCl3,其原因是(结合离子方程式简要说明) 。
27.(16分)某校活动小组用下图所示装置及所给药品(图中夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知C中的浓硫酸含溶质
m mol,假设气体进入C和D时分别被完全吸收,且忽略装置内空气中的CO2。
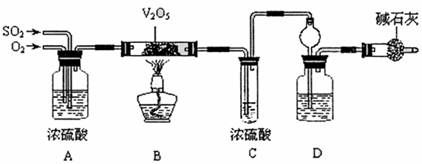
请回答下列问题:
(1)已知0.5 mol SO2被O2氧化成气态SO3,放出49.15kJ热量,反应的热化学方程式为 。
(2)检查完装置的气密性且加入药品后,开始进行实验,此时首先应进行的操作是
。
(3)实验时A中氧气导冒出的气泡与二氧化硫导管冒出的气泡速率相近,其目的是
;装置C中浓硫酸的作用为 ;
装置D中盛放的溶液中足量的 (选填字母)。
a.BaCl2溶液 b.NaOH溶液 c.NaHSO3饱和溶液
(4)停止通入SO2,熄灭酒精后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是 。
(5)实验结束后,稀释装置C中的溶液,并向其中加入足量的BaCl2溶液,得到的沉淀质量为wg。若装置D增加的质量为ag,则此条件下二氧化硫的转化率是
(用含字母的代数表示,结果可不化简)。
26.(16分)短周期元素A、B、C、D原子序数依次增大,且只有C为金属元素。A、C位
于同一主族,B的最外层电子数次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等。
请回答下列问题:
(1)D的最高价氧化物对应水化物名称为 。
(2)C2B2的电子式为 ,其中含有的化学键类型为 。
(3)由上述四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分。将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应离子方程式为 。
(4)用石墨电极电解CD的饱和溶液,反应的离子方程式为 ,若反应的溶液的体积为200mL,测得pH为13,则阳极得到的气体质量为 ,外电路中通过电子的物质的量为 。
(5)实验室欲检验CD溶液中所含的D-,操作方法和现象为 。
25.(14分)已知一定条件下,烯烃可发生下列反应:
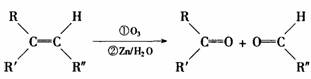
现有如下转化关系,其中A是蜂王浆中的有效成分,分子工为C10H18O3,具有酸性。B 能被NaOH溶液中和。C中没有支链,也不含-CH3。G是六元环状化合物,分子式为C4H4O4。

请回答:
(1)B中的官能团名称为 。
(2)E与足量的新制氢氧化铜悬浊液反应的化学方程为 。
(3)D与F反应生成G的化学方程式为 ;分子中有2个羧基、且能使Br2的CCl4溶液褪色的G的同分异构体有 _______(写结构式)。
(4)A的结构简式为 ;A的加聚产物是一种功能高分子材料,其结构简式为 。
12.常温下,将V1 mLc1mol/L的氨水滴加到V2 mLc2mol/L的盐酸中,下列结论正确的是( )
A.若V1=V2,且溶液的pH<7,则一定有c1<c2
B.若c1=c2,V1=V2,则混合液中c(NH4+)=c(Cl-)
C.若混合液的pH=7,则混合液中c(NH4+)>c(Cl-)
D.若混合液的pH=7,则混合液中c1V1>c2V2
第Ⅱ卷(非选择题 共180分)
本卷共11小题,共180分。
11.下列实验方法正确的是 ( )
|
B.加入适量NaOH溶液后过滤,以除去KCl溶液中少量的MgCl2
C.H2还原CuO实验中,当固体变红后,先停止通H2,再停止加热
D.测定硫酸铜晶体中结晶水含量,加热坩埚中的警惕,失水后需在空气中冷却,再称量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com