
29.(20分)I.在足量的稀氯化亚铁溶液中,加入1-2滴液溴,振荡后溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是:________________(填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物质是___________________.
(2)现提供以下试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液
C.四氯化碳 D.硫氰化钾溶液
请判断哪位同学的推断是正确的,并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象。
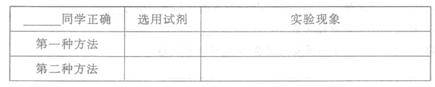
(3)根据以上述实验推测,若在稀溴化亚铁溶液中通人氯气,首先被氧化的离子是______________.
(4)若选用淀粉碘化钾溶液来判断(1)中哪位同学的推断是正确的,你认为是否可行?_________;
理由是:________________________________________________________________。
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约1min后用气唧鼓入空气。请填写下列空白:
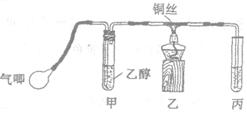
(1)乙醇发生催化氧化的化学反应方程式为
____________________________________________________________________________.
(2)由于装置设计上的缺陷,实验进行时可能会_________________________________.
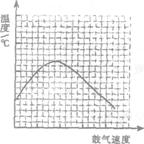 (3)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行.进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。
(3)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行.进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。
试解释鼓气速度过快,反应体系温度反而下降的原因:
____________________________________;你认为该实验中“鼓气速度”
这一变量可通过观察___________来控制。
28.(8分)A、B、C、D、E为五种常见的短周期元素,常温下A、B可形成B2A2和B2A两种液态化合物,B与D可形成分子X,也可形成阳离子Y,X、Y在水溶液中酸、碱性恰好相反,C元素的焰色反应呈黄色,E与C同周期,且E的最高价氧化物的水化物呈两性。试回答:
(1)D元素处于周期表中________________________;
(2)A、D、E三种元素形成的盐(化学式为A9D3E)的水溶液呈_______性,用离子方程式解释其原因____________________________________________________________ ;
(3)w、Q是由A、B、C、D四种元素中任意三种组成的不同类型的强电解质,常温下0.1mol·L-1 W的水溶液的pH为13,Q的水溶液呈酸性,且物质的量浓度相同的W、Q溶液中水的电离程度:前者小于后者,则W为____________,Q为____________(填化学式).
(4)用A单质和B单质可制取气体燃料电池,该电池用多孔的惰性电极浸入浓KOH溶液,两极分别通入A单质和B单质。写出该电池负极的电极反应式:______________________________________。
15.可逆反应mA(g)+nB(g) pC(g)+gD(g)的
pC(g)+gD(g)的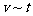 图像如下左图,若其它条件都不变,只是在反应前加入合适的催化剂,则其
图像如下左图,若其它条件都不变,只是在反应前加入合适的催化剂,则其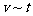 图像如下右图。
图像如下右图。

①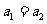 ②
②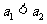 ③
③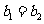 ④
④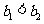 ⑤
⑤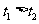 ⑥
⑥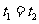 ⑦两图中阴影部分面积相等 ⑧右图阴影部分面积更大 以上正确的为
⑦两图中阴影部分面积相等 ⑧右图阴影部分面积更大 以上正确的为
A.②④⑤⑦ B.①④⑥⑧ C.②③⑤⑧ D.①③⑥⑦
第Ⅱ卷(必做120分+选做32分,共152分)
[必做部分]
14.如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管 ①内的水立刻沸腾了。则液体A和气体B的组合不可能是下列的
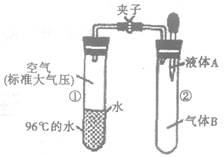
A.氢氧化钠溶液、二氧化碳
B.水、氨气
C.氢氧化钠溶液、一氧化氮
D.水、二氧化氮
13.已知常温下:Ksp[Mg(OH)2]=1.2×10-11mol3·L-3,Ksp(AgCl)=1.8×10-10mol2·L-2, Ksp(Ag2S)=6.3×10-50mol3·L-3,Ksp(CH3COOAg)=2.3×10-3mol2·L-2下列叙述正确的是
A.等体积混合浓度均为0.02mol·L-1的AgNO3溶液和CH3COONa溶液一定产生CH3COOAg沉淀
B.将0.001mol·L-1的AgNO3溶液滴入0.001mol·L-1的KCl和0.001mol·L-1的K2S溶液中先产生AgCl沉淀
C.在Mg2+为0.12mol·L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH至少要控制在9以上
D.向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)变大
12.某溶液中含有Cl-、SO42-、Fe3+、K+、M,且离子物质的量之比为2:3:1:3:1,则微粒M可能为
A.Na+ B.Mg2+ C.Al3+ D.Ba2+
11.设NA为阿伏加德罗常数的值,下列叙述中正确的是
A.电解精炼铜时转移NA个电子,阳极溶解32g铜
B.100g的98%的浓H2SO4中所含的氧原子数为4NA
C.2molSO2和1molO2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2NA
D.含1mol FeCl3的饱和溶液加入到沸水中形成氢氧化铁胶体,胶体微粒数目约为NA
10.分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是
①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
④根据反应中的热效应将化学反应分为放热反应和吸热反应
⑤根据氧化物的组成将所有氧化物分为碱性、两性和酸性氧化物
⑥微粒间相互作用可分为化学键(如离子键、共价键、氢键等)和分子间作用力
A.①③ B.②④ C.①②④⑥ D.②③④⑤
9.市场上出现了各种各样的营养食盐,如:锌营养盐、钙营养盐、硒营养盐、低钠营养盐、加碘营养盐等十多种营养保健盐。下列说法正确的是
A.加碘食盐是在食盐中加入了碘单质
B.钙营养盐是在食盐中加入了氯化钙或碳酸钙等含钙化合物
C.低钠盐中的钠离子比氯离子少,所以低钠盐是一种带负电的物质
D.各类营养盐的主要成分都是氯化物
29.(17分)某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究。
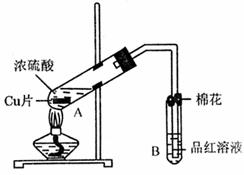
(1)写出试管B中的实验现象 。
(2)写出A中反应的化学方程式 。
(3)继续向A试管中加入H2O2,发现铜片溶解,反应的离子方程式为:
。
若仍不补充浓硫酸,只要求使铜片溶解,也可以加入(填写两种属于不同类别物质的化学式) 、 。
(4)B试管口的棉花应沾有的试剂是 。
(5)小组成员向反应后的溶液中加入足量的氧化铜,使剩余的硫酸全部转化为硫酸铜,过滤后,将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4·xH2O)。小组成员采用加热法测定该晶体里结晶水x的值
①在他们的实验操作中,至少称量 次;
②下面是其中一次实验的数据:
|
坩埚质量 |
坩埚与晶体的总质量 |
加热后坩埚与固体总质量 |
|
11.7g |
22.7g |
18.9g |
根据上表数据计算判断x的实侧值比理论值(x=5) (填“偏大”、“偏小”),
这次实验中产生误差的原因可能是 (填序号)
A.硫酸铜晶体中含有不挥发的杂质 B.实验前晶体表面有湿存水
C.加热时有晶体飞溅出去 D.加热失水后露置在空气中冷却
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com