
4.下列用于制备相应金属的反应原理中,不可行的是
A.用氢气还原氧化铝制备铝
B.用一氧化碳还原氧化铁制备铁
C.电解熔融氯化镁制备镁
D.加热孔雀石和木炭的混合物得到铜
3.用特殊方法把固体物质加工到纳米级(1--100nm,inm=lO-9m)的超细粉末粒子,然
后制得纳米材料,下列分散系中分散质的微粒直径和这种粒子具有相同数量级的是
A.溶液 B.悬浊液 C.胶体 D.乳浊液
2.都能用氢氧化钠溶液进行喷泉实验的一组气体是
A.SO2和CO B.NH3和N2 C.N02和NO D.HCl和C02
1.下列环境问题与二氧化硫的排放有关的是
A.臭氧空洞 B.光化学烟雾 C.温室效应 D.酸雨
25.取3.O0g硬铝合金(主要含铝,其次是镁、硅、铜)向其中加入足量盐酸,待反应完毕后,收集到标准状况下气体3472mL。则实际参加反应的盐酸的物质的量为:____________。将反应混合物过滤,向滤液中加入过量的NaOH溶液,充分反应后再过滤;向滤液中通入足量的C02,滤出沉淀。将沉淀加热蒸千、灼烧,得白色固体5.10g。请计算这种硬铝合金中含镁的质量分数。(已知:Na[AI(OH)4]溶液与CO2 反应生成Al(OH)3。)(写出计算过程)
24.在硅的冶炼中,通常用氢气在高温下还原四氯化硅的方法制得单质硅。其化学方程式为:_________________
现需冶炼14kg单质硅,试计算至少需要消耗标准状况下的氢气__________升。
23.为了预防碘缺乏症,国家规定每千克食盐中应含40-50mg碘酸钾。工业生产碘酸钾的流程如下:
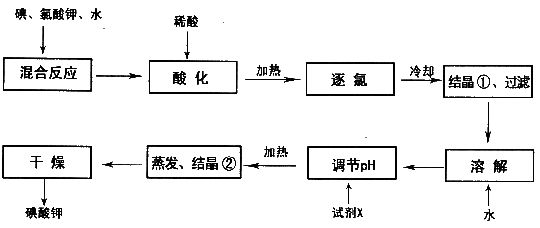
(1)碘单质通常情况下为______色______态(填固、液或气)。
(2)碘、氯酸钾和水混合后的反应为:I2+KClO3+H20→ KH(I03)2+KCl+Cl2↑
在此反应中的氧化剂为:______。 氧化产物为:______。
(3)X的化学式为:___________,写出用试剂x调节pH的化学方程式_______________。
(二)甲同学确定了试剂的成分后,乙同学在甲同学的基础上又设计了如下的方案进一步定量分析。如图所示:
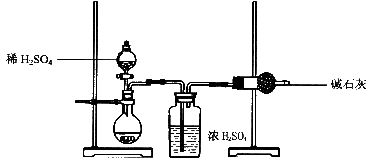
(1)根据乙同学的实验装置图分析,在实验过程中必须用天平进行称量的操作有:
①___________________②_____________________③____________________
(2)取试剂mg于烧瓶中,加足量的硫酸,最终称得碱石灰增重ng(假设气体完全吸收),则mg固体中,各成分的质量分别为(用含m n的式子表示)_____________________。
(一)甲同学的方案是:
取少量样品溶解,加过量氯化钡溶液,有沉淀生成,过滤,取沉淀加盐酸,有气体生成。取滤液,加氯化镁溶液,有白色沉淀生成。则瓶中试剂的成分为:
甲同学需选用的玻璃仪器有________________________。
21.下图是一个制取氯气并以氯气为原料进行特定反应的装置,请回答下列问题。
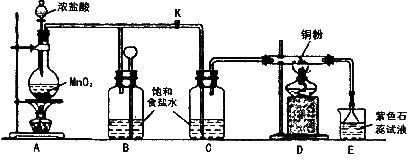
(1)A是氯气发生装置,其中发生反应的化学方程式为:______________此反应的还原剂为:__________________.
(2)实验开始时,先点燃装置A处的酒精灯,打开弹簧夹K,让Cl2 充满整个装置,再点燃装置D处的酒精灯,Cl2通过C瓶后再进入D(D装置的硬质玻璃管内盛有铜粉)。D中发生反应的化学方程式为:____________,装置C的作用是___________。
(3)实验过程中,E处产生的现象为____________。
(4)D处反应完毕后,关闭弹簧夹K,移去酒精灯,由于余热的作用,A处仍有Cl2 产生,此时B中出现的现象是__________________。
(5)若在实验中要制取标况下的氯气2.24 L,则需要8 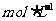 盐酸的体积:_______________。
盐酸的体积:_______________。
22.某研究性小组在实验室发现一瓶敞口放置的氢氧化钠试剂瓶,若原来瓶中为固体氢氧
化钠,请你预测现在瓶中试剂可能的成分:___________________。
为验证瓶中物质的成分,甲、乙两位同学分别设计了如下的实验方案:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com