
1.在我们的日常生活中出现了“加碘食盐”、“增铁酱油”、“高钙牛奶”、“富硒茶叶”、“含氟牙膏”等商品。这里的碘、铁、钙、硒、氟应理解为
A.元素 B.单质 C.分子 D.氧化物
22.(9分)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
 CO(g)+H20(g),其化学平衡常数Kc和温度t的关系如下表:
CO(g)+H20(g),其化学平衡常数Kc和温度t的关系如下表:
|
t/℃vc |
700 |
800 |
830 |
1000 |
1200 |
|
Kc |
0.6 |
O.9 |
1.O |
1.7 |
2.25 |
试回答下列问题:
(1)该反应的正反应为____(选填“吸热”或“放热”)反应;
(2)能判断该反应是否达到化学平衡状态的依据是下列中的(填字母标号)_____;
A.容器中压强不变
B.混合气体中c(C0)不变
C.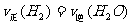
D.c(C02)=c(CO)
(3)1200℃时,浓度分别为0.9 mol·L-1的CO2(气)和H2,在密闭容器中充分反应,达平衡时,求CO2的转化率。
21.(11分)已知两个醛分子在碱性溶液中可以发生加成反应: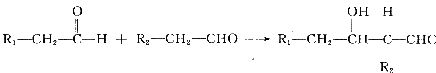
A是一种可以作为药物的有机化合物,已知下图反应式中各有机物的衍生关系(所有无机产物均已略去)。

又知:
①完全燃烧106 g有机物M,得到标准状况下156.8L CO2和54 g H2O;核磁共振氢谱显示M
分子中有4种不同结构位置的氢原子;M的相对分子质量在100-200之间。
②E的分子模型如右下图所示(图中球与球之间的连线代表化学键,如单键、双键等):
请回答下列问题:

(1)M的分子式是____E的结构简式是____
(2)写出C+B反应的化学方程式。____________________。
(3)F有很多同分异构体,含有酯基和一取代苯结构的F的同分异构体有六种,其中四种结构
简式是

请写出另外两种同分异构体的结构简式:________________________。
20.(8分)26℃时,在3L密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如右图所示。请回答下列问题:

(1)反应开始至2 min时,Y的平均反应速率是______。
(2)写出X、Y、Z的可逆反应化学方程式。_________。
(3)在20%时,将2mol X和6 molY通入3L的密闭容器中发生反应并达到化学平衡状态I,若 X、Y、Z的起始物质的量分别用a、b、c表示,要使反应达到上面的平衡状态I、a、b、c的取 值必须满足的一般条件是(用两个方程式表示,一个只含a和c,另一个只含b和c): _____、_____.
(4)将2mol X和6mol Y 混合后置于体积可变的密闭容器中,在一定温度下达到平衡状态Ⅱ,测得气体的总物质的量为7.5 mol。设X、Y、Z的起始物质的量分别用a、b、c表示,若保持原温度不变,要使反应开始时向逆反应方向进行,且仍能达到上述平衡状态Ⅱ,则起始时c的取值范围是______。
19.(5分)已知0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ的热量。
(1)写出该反应的热化学方程式_______________________;
(2)又已知H20(1)H===H2O(g),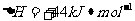 ,5.6g乙硼烷(B2H6)在氧气中燃烧生
,5.6g乙硼烷(B2H6)在氧气中燃烧生
成气态水时放出的热量是____
18.(12分)人体血液里Ca2+的浓度一般采用g·L-1表示,今抽一血样20.00mL,加适量的草酸铵[(NH4)2C204]溶液,可析出草酸钙(CaC204。)沉淀。将此沉淀过滤洗涤后溶于稀硫酸可得草酸,再用0.002  KMnO4。溶液滴定,使草酸转化成CO2逸出,反应的离子方程式为:5H2C204+2MnO4-+6H+===2Mn2++10C02↑+8H2O。
KMnO4。溶液滴定,使草酸转化成CO2逸出,反应的离子方程式为:5H2C204+2MnO4-+6H+===2Mn2++10C02↑+8H2O。


(1)滴定时,KMnO4溶液应装在右图中的____(填甲或乙)滴定管中。操作时,左手____,右手____.
(2)滴定时,根据现象_______,即可确定反应达到终点,因此,不必另外再加指示剂
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为____ mL,终点读数为____mL
经过计算,血液样品中Ca2+的浓度为____g·L-1。
(4)下列操作中可能使所测血液里Ca2+的浓度数值偏低的是____ (填正确选项的字母标号)
A.滴定管未用标准KMnO4溶液润洗,就直接注入标准KMn04溶液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出
F.将锥形瓶用待测液润洗,然后加入待测液,再进行滴定
16.Cu(OH)2在水中存在着如下沉淀溶解平衡:Cu(OH)2(s)
 Cu2+(aq)+20H-(aq)。在常温下Ksp=2×10-20
Cu2+(aq)+20H-(aq)。在常温下Ksp=2×10-20 。某CuSO4溶液中,c(Cu2+)==0.02
。某CuSO4溶液中,c(Cu2+)==0.02 ,在常温下如果要生成Cu(OH)2 沉淀,需要向CuSO4溶液中加入碱溶液来调整溶液的pH,使溶液的pH大于
,在常温下如果要生成Cu(OH)2 沉淀,需要向CuSO4溶液中加入碱溶液来调整溶液的pH,使溶液的pH大于
A.2 B.3 C.4 D.5
第Ⅱ卷 (非选择题共52分)

(1)所选仪器连接时,各接口顺序是(填各接口的字每标号):
____接____、____接A, B接____、____接____
(2)实验时,装置中的铂电极接电源的____极;铁电极的电极反应式为________此电解总反应的化学方程式为__________。
15.在某容积一定的密闭容器中,可逆反应:A(g)+B(g)

 C(g),符合下列图象(I)所示关系,由此推断对图(Ⅱ)的正确说法是
C(g),符合下列图象(I)所示关系,由此推断对图(Ⅱ)的正确说法是


A. P3>P4,Y轴表示A的转化率
B.P3<P4,Y轴表示B的质量分数
C.P3>P4,Y轴表示混合气体密度
D.P3<P4,Y轴表示混合气体平均摩尔质量
14.科学工作者为心脏病人设计的心脏起搏器的电池是以Pt和Zn为电极材料,依靠人体内液体中含有一定浓度的溶解氧。H+和Zn2+进行工作的。该电池在进行工作时,正极上的电极反应为
A.Zn→Zn2++2e- B.2H++2e-→H2↑
C.2H2O+O2+4e-→4OH- D.02+4H++4e-→2H20
13.pH=2的强酸溶液与pH=13的强碱溶液混合,所得混合液的pH=1l,则强酸溶液与强碱溶液的体积比
A.11:1 B.9:1 C.1:10 D.1:8
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com