
9.目前常用我银锌电池的总反应为 ,则下列对该反应的叙述中,都正确的选是 ( )
,则下列对该反应的叙述中,都正确的选是 ( )
①该反应是可逆反应;②放电时锌为负极;③充电时,化学能转化为电能;
④放电时,化学能转化为电能;⑤左边反应物的总能量高于右边生成物的总能量
A.①②⑤ B.②③⑤ C.①④⑤ D.②④⑤
8.20℃时有ag硫酸铜溶液V mL。将溶液蒸发掉bg水后恢复到20℃,恰好全部生成硫酸铜晶体(CuSO4·5H2O),则下列关系式错误是 ( )
A.原硫酸铜溶液的密度为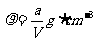
B.生成硫酸铜晶体的物质的量为n(CnSO4·5H2O)=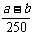 mol
mol
C.原硫酸铜溶液的物质的量浓度为c(CuSO4)=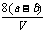 mol·L-1
mol·L-1
D.原硫酸铜溶液的质量分数为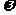 (CuSO4)=
(CuSO4)=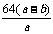 %
%
7. 某有机物结构简式为CH3-CH-CH=CH-CHO,该有机物不可能发生的化学反应是
某有机物结构简式为CH3-CH-CH=CH-CHO,该有机物不可能发生的化学反应是
Cl ( )
①氧化 ②取代 ③加成 ④消去 ⑤还原 ⑥酯化 ⑦水解 ⑧加聚
A.② B.④ C.⑥ D.⑧
6.下列有关实验及操作的叙述中,错误的是 ( )
A.用溴水将苯、乙酸、四氯化碳区分开来
B.在实验室中通常将钠保存在汽油里
C.用稀硝酸洗去残留在试管壁上的银
D.如果苯酚溶液沾到皮肤上,应立即用酒精洗涤
5.下列有关甲醇(CH3OH)说法正确的是 ( )
A.甲醇的极性分子,可与水以任意比互溶
B.甲醇与甲烷分子结构相同,都是正四面体结构
C.甲醇与乙醇都是饮用酒中的主要成分
D.1mol甲醇分子中含4mol共用电子对
28.(16分)以A为原料在化学工业上可制备多种物质,其中的一部分如图所示。A、B、D、E、G的焰色反应均呈黄色,A是由同周期元素组成的离子化合物,其水溶液呈中性,B、D、E的水溶液均呈碱性。常温下,X2为黄绿色气体。当G转化为D或E时,同时生成能支持燃烧的无色气体Y2。
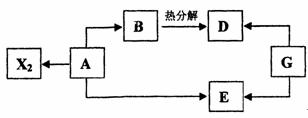
试回答下列问题:
(1)G的化学式为 ,A的电子式为 ,E中的化学键类型为 。
(2)工业上以A为原料制取E的离子方程式为 。
(3)B溶液呈碱性的理由是(用离子方程式表示) 。
(4)D在工业上可用于减轻含硫燃料燃烧时的SO2污染。将D粉末与燃料一起喷进燃炉,D与SO2反应产生固体(该固体可进一步被氧化),反应的化学方程式为
。
(5)在X、Y两种元素组成的某种化合物中,Y元素的质量分数为47.4%。该化合物与NaOH反应生成两种含氧酸盐,其中X的化合物分别为+3价和+5价,反应的化学方程式为 。
27.(15分)下图中,甲由C、H、O三种元素组成,元素的质量比为12:3:8,甲的沸点为78.5℃,
其蒸气与H2的相对密度是23。将温度控制在400℃以下,按要求完成实验。
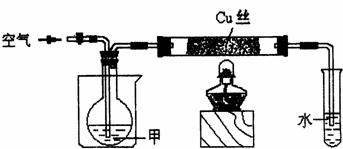
(1)在通入空气的条件下进行实验Ⅰ。
①甲的名称是 ,加入药品后的操作依次是 。
a.打开活塞 b.用鼓气气球不断鼓入空气 c.点燃酒精灯给铜丝加热
②实验结束,取试管中的溶液与新制的Cu(OH)2混合,加热至沸腾,实验现象为
。
③现用10%的NaOH溶液和2%的CuSO4溶液,制取本实验所用试剂Cu(OH)2,请简述实验操作。
。
(2)在停止通入空气的条件下进行实验Ⅱ。
①关闭活塞,为使甲持续进入反应管中,需要进行的操作是
。
②甲蒸气进入反应管后,在铜做催化剂有250~350℃条件下发生可逆的化学反应,
在试管中收集到了实验Ⅰ相同的产物,并有可燃性气体单质放出。该反应揭示了甲
催化氧化的本质。写出实验Ⅱ中反应的化学方程式,并结合该化学方程式简要说明实验Ⅰ中所通空气的作用。
26.(14分)A、B、C、D四种短周期元素的原子半径依次减小,在周期表中B与A、C相邻,C的最外层电子数是其电子总数的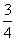 ,D能分别与A、B、C形成电子总数相等的化合物X、Y、Z。试回答:
,D能分别与A、B、C形成电子总数相等的化合物X、Y、Z。试回答:
(1)在X、Y、Z三种化合物中,沸点最高的是(用化学式表示,下同) ,
稳定性由强到弱的顺序是 。
(2)若由A、B、C、D四种元素组成一种离子化合物,1 mol该化合物中含有10 mol原子,则该化合物受热分解的化学方程式为 。
若由A、B、C、D四种元素中的两种组成化合物,化合物中分子的空间构型为直线型。写出符合上述要求且原子数不少于3的任意两种化合物的结构式:
。
(3)Y跟HCl反应生成固体。该固体跟有毒的工业盐NaNO2的水溶液混合加热,NaNO2被完全破坏,当有1 mol NaNO2发生反应时,共有3 mol电子转移,该反应的化学方程式为 。
25.(15分)利胆解痉药“亮菌甲素”跟(CH3)2SO4反应生成A。二者的结构简式如图。
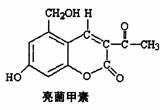
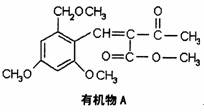
试回答:
(1)“亮菌甲素”的分子式为 ,1mol“亮菌甲素”跟浓溴水反应时最多消耗 mol Br2;A不能发生的化学反应有 。
①加成反应 ②酯化反应 ③水解反应 ④消去反应
(2)有机物A能发生如下转化。
提示:
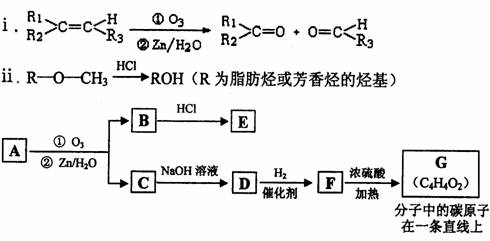
①C→D的化学方程式为 。
②1 mol G跟1 mol H2在一定条件下反应,生在物的结构简式为 。
③符合下列条件的E的同分异构体有 种,写出其中任意一种的结构简式。
a.遇FeCl3溶液呈紫色
b.不能发生水解反应,能发生银镜反应
c.苯环上的一氯取代物只有一种,分子中无甲基
12.已知某溶液中存在H+、OH-、NH4+、Cl-,其离子浓度大小不可能是 ( )
A.c(Cl-)=c(NH4+)>c(H+)=c(OH-) B.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
C.c(Cl-)>c(NH4+)>c(H+)>c(OH-) D.c(OH-)>c(H+)>c(Cl-)>c(NH4+)
第Ⅱ卷(非选择题 21-31题共11题 共180分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com