
14.下列离子方程式的书写中,正确的是 ( )
 A.电解饱和食盐水:2Cl-+ 2H+ H2↑+ Cl2↑
A.电解饱和食盐水:2Cl-+ 2H+ H2↑+ Cl2↑
 B.铜片插入三氯化铁溶液中:Cu + 2Fe3+ Cu2+
+ 2Fe2+
B.铜片插入三氯化铁溶液中:Cu + 2Fe3+ Cu2+
+ 2Fe2+
 C.氢氧化亚铁与稀硝酸混合:Fe(OH)2
+ 2H+ Fe2+
+ 2H2O
C.氢氧化亚铁与稀硝酸混合:Fe(OH)2
+ 2H+ Fe2+
+ 2H2O
 D.碳酸钠溶液与醋酸溶液混合:CO32- + 2H+ CO2↑+ H2O
D.碳酸钠溶液与醋酸溶液混合:CO32- + 2H+ CO2↑+ H2O
13.在指定环境中,下列各组离子可以大量共存的是 ( )
A.在中性溶液中:Al3+、K+、SO42-、HCO3-
B.在某水溶液中:Fe2+、NH4+、ClO-、Cl-
C.在强碱性溶液中:S2-、SO32-、K+、Na+、CO32-
D.在酸性溶液中:[Al(OH)4]-、I-、NO3-、Na+
12.下列说法中,正确的是 ( )
A.在101kPa下,1mol任何气体的体积都约为22.4L
B.等物质的量在C2H4和CH3CH2OH完全燃烧时,消耗O2的体积(同条件)相同
C.相同条件下,98%的浓硫酸和49%的H2SO4溶液的物质的量浓度之比等于2
D.25℃时,CH3COOH分子不可能存在于pH > 7的溶液中
11.几种短周期元素的主要化合价及原子的原子半径数据见下表:
|
元素代号 |
L |
M |
Q |
R |
T |
|
主要化合价 |
+2 |
+3 |
+6、-2 |
+7、-1 |
-2 |
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.099 |
0.074 |
据表中信息判断,下列有关叙述中,正确的是 ( )
A.L、M的单质分别与同浓度的稀盐酸反应时,M的单质反应更剧烈
B.M与T形成的化合物能和强酸、强碱反应
C.Q、T两元素的氢化物热稳定性比较:Q的氢化物大于T的氢化物
D.L与R两元素形成的化合物中,含有共价键
10.下列叙述中,不正确的是 ( )
A.Cl2和SO2分别通入品红试液中,均使品红试液褪色
B.硝酸银溶液通常保存在棕色试剂瓶中
C.常温下,铁和铝与浓硫酸不发生任何反应
D.葡萄糖与新制的Cu(OH)2悬浊液反应,有砖红色物质生成
9.人们生存的环境与化学息息相关,下列说法中,你认为正确的是 ( )
A.汽车尾气中含有能污染空气的氮的氧化物,原因是汽油燃烧不充分
B.酸雨的形成主要是因为森林的过度采伐
C.清晨,日出后的密林中可看到缕缕光束,原因是清晨林间CO2的浓度较大
D.钢铁在潮湿的空气中更易生锈,是因为形成了原电池的缘故
32.(8分)[化学----物质结构与性质]
根据下列五种l-20号元素的电离能数据(单位:kJ/mol),回答下列问题。
|
元素代号 |
I1 |
I2 |
I3 |
I4 |
|
X |
2080 |
4000 |
61OO |
9400 |
|
Y |
500 |
4600 |
6900 |
9500 |
|
Z |
740 |
1500 |
7700 |
10500 |
|
M |
580 |
1800 |
2700 |
11600 |
|
N |
420 |
4100 |
6400 |
8900 |
(1)据上表可推断,上述五种元素,处于周期表中同一族的是__________(填字母)。
A.X和Y B.Z和M C.M和N D.Y和M E.Y和N
(2)电解它们熔融的最高价氧化物,阴极电极反应式正确的是__________________(填字母)。
A.X2++2e→X B.Y2++2e一→Y C.Z3++3e一→Z
D.M3++3e一→M E.N2++2e一→N
(3)若X元素原子的最外层有2个P电子,则X的氯化物的化学键类型是______________,其空间构型是__________________。
(4)M元素原子的最外层电子排布式是________________,Z元素的单质形成的晶体类型是___________________。
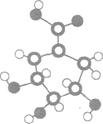 33.(8分)[化学----有机化学基础]
33.(8分)[化学----有机化学基础]
相对分子质量为174的有机物M中只含有C、H、O三种元素,
其分子结构如图所示。
请回答下列问题:
(1)M的结构筒式是__________________。
(2)下列关于M的说法,正确的是___________
A.遇FeCl3溶液呈紫色 B.遇紫色石蕊溶液变红色
 C.遇溴水发生取代反应 D.能缩聚为高分子化合物
C.遇溴水发生取代反应 D.能缩聚为高分子化合物
(3)M在一定条件下可发生反应,生成HO 一COOH,该反应的化学方程式是_________________________,反应类型为_________________________________。
(4)M与有机物A在一定条件下可生成一种相对分子质量为202的酯类物质。A可能的结构简式是___________________。
31.(8分)[化学-化学与技术]
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
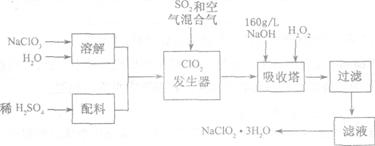
已知:
(1)NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到l0%以下安全。
(1)发生器中鼓入空气的作用可能是___________________________________。
(2)吸收塔内的反应的化学方程式为_________________________。
吸收塔的温度不能超过20℃,其目的是防止H2O2分解,写出H2O2分解的化学方程式:_____________________。
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是____________________________。
(4)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是____________________。
30.(14分)有A、B、C、D 4种无机物,它们在一定条件下具有如下图所示的转化关系。

回答下列问题:
(1)若以上反应均为氧化还原反应,且A、B、C均含有同一种元素;
①若D为非金属单质,则C的化学式为___________________________。(写出一种物质即可)
②若D为金属单质,请写出检验B中阳离子的一种方法_____________________________。
(2)若以上反应均为非氧化还原反应;
①当D为酸时,则A、B、C、D分别可以是_______________________________________。
②当D为酸性气体(常温下)时,则A、B、C、D分别可以是_________________________。
③当D为碱时,则A、B、C、D分别可以是_______________________________________。
(以上均按顺序写出合理的一组物质的化学式即可)
[选做部分]
共8个题,考生从中选择2个物理题、1个化学题和1个生物题作答。
29.(14分)某校化学课外小组的同学为了探究碳酸钠和碳酸氢钠两种物质的性质,做了如下实验:
实验I.如图A-D所示。

(1)若用实验D来验证碳酸钠和碳酸氢钠的热稳定性,则试管b中装入的固体最好是_____________________,实验现象是___________________________。
(2)若用实验来鉴别碳酸钠和碳酸氢钠两种固体,能达到实验目的的是(填装置序号)_________________。
(3)若测定Na2CO3固体中混有的少量NaHCO3的质量分数,C能否达到实验目的? 若能,请说明其计算所需的数据__________________;若不能,请简要说明理由_______________________________。
实验II.将碳酸钠与碳酸氢钠溶液分别与澄清石灰水混合并充分反应。
(1)当石灰水过量时,反应的离子方程式分别为__________________、_________________。
(2)当碳酸氢钠与氢氧化钙物质的量之比为2:1时,所得溶液中溶质的化学式为_________________,请设计实验检验所得溶液中溶质的阴离子__________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com