
9.2007年3月温家宝总理在十届全国人大五次会议上提出“要大力抓好节能降耗、保护环境”,下列举措与这一主题不相符的是
A.用“绿色化学”工艺,使原料完全转化为目标产物
B.推广燃煤脱硫技术,减少SO:污染
C.推广垃圾的分类存放、回收、处理
D.大量使用农药化肥以提高粮食产量
27.(8分)3.84g铜和一定量的浓硝酸反应,当铜反应完毕时,共收集到气体(NO、NO2的混合物)的体积为2.24L(标准状况)。试计算:
(l)反应中消耗硝酸的总物质的量;
(2)生成的气体中NO、NO2各自的物质的量。
26.(6分)常温下,在27.5g水中溶解12.5gCuSO4·5H2O,恰好达到饱和,该溶液的密度为1.21g/cm3,则 (l)该溶液中阴阳离子的总物质的量为 ;
(2)该溶液中CuSO4的物质的量浓度为 ;
(3)取出20.0mL该溶液,配成浓度为1.00mol/L的溶液,稀释后溶液的体积为 。
25.(8分)已知,一些活泼金属可以作还原剂,将相对不活泼的金属从其化合物中置换出来。如:铝可以在一定条件下与WO3、铁的氧化物等反应分别生成氧化铝和金属钨、铁等。
A、B、C、D是四种常见单质,其对应的核电荷数依次增大,甲、乙、丙为常见化合物。它们之间有如下转化关系:
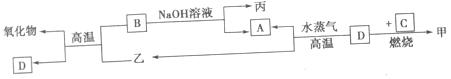
回答下列问题: (1)B与NaOH溶液反应的离子方程式是 ,
D与甲溶液反应的离子方程式是 。
(2)一定条件下,2molB与3molD的氧化物W恰好完全反应生成D和另一种氧化物,则W是 。 (3)将甲的浓溶液滴入到沸水中,并继续加热能得到红褐色的液体,区别该分散系是胶体还是溶液的最简便方法称为 。
24.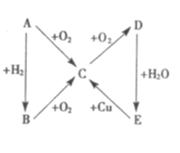 (6分)根据右图所示的A 、B 、C 、D 、E 五种物质的相互转化关系,又知A
是气体。按如下要求填写相应的物质的化学式和有关反应的化学方程式:
(6分)根据右图所示的A 、B 、C 、D 、E 五种物质的相互转化关系,又知A
是气体。按如下要求填写相应的物质的化学式和有关反应的化学方程式:
(1)B ,C是 。
(2)由D生成E反应的化学方程式是 。
23.( 4 分)图A是一种用于显示事物异同点的信息处理方法。两个圆分别代表铝和铁的有关信息,两圆重叠的区域表示铝和铁的共同特征(相似点),重叠区域以外的部分表示它们独有的特征(不同点)。请你在图下的空格内填写与图B 、图C和图A 中的①②③④区域对应的适当内容(每处只要求填一点)。
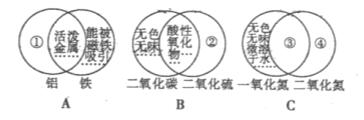
① ;② ;
③ ;④ 。
22.(14分)为除去粗盐中的Ca2+、Mg2十、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
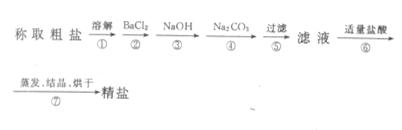
( 1 )判断BaCl2已过量的方法是 。
( 2 )第④步中,相关的离子方程式是 。
( 3 )若先用盐酸调pH 再过滤,将对实验结果产生影响,其原因是 。
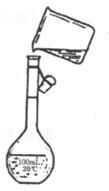
( 4 )为检验精盐纯度,需配制150mL.0.2mol/LnaCI(精盐)溶液,如图是该同学转移溶液的示意图,图中的错误是 。
21.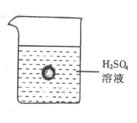 (4分)如图所示,一烧杯中盛有H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央。向该烧杯里缓缓注入Ba(OH)2溶液至恰好完全反应。
(4分)如图所示,一烧杯中盛有H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央。向该烧杯里缓缓注入Ba(OH)2溶液至恰好完全反应。
试回答在此实验过程中,观察到的实验现象有:
(1) 。(2) 。
20.实验室有一瓶久置的白色粉末,元素分析证明它由钾、硫、氧三种元素组成,钾和硫的质量比为39:16 ,下列结论正确的是 A.根据元素分析结果推测该粉末为纯净物 B.将粉末溶于水,加人氯化钡,观察到有白色沉淀生成,证明原粉末是硫酸钾
C.将粉末加人盐酸中,产生气泡,证明原粉末是亚硫酸钾 D.将粉末溶于水,加人氯化钡和盐酸,观察到有白色沉淀和气泡生成,证明原粉末是硫酸钾和亚硫酸钾的混合物 第Ⅱ卷(非选择题共50分)
13.室温下,在强酸性和强碱性溶液中都不能大量共存的离子组是
A.NH+4、Cu2+ 、CI-、NO2-
B.K+、Na+、CO32-、SO42-
C.K+、Na+、AlO-2、SO42-
D.Ba2+、Fe2+、NO3-、Br-
14.下列反应的离子方程式错误的是
A.铁跟稀硫酸反应Fe + 2H+= Fe2+ + H2
B.铜跟浓硝酸反应Cu + 2NO3-+4H+ = Cu2+ + 2 NO2↑+2H2O
C.碳酸钙跟稀盐酸反应CO32-+2H+=CO2↑+H2O
D.铁跟氯化铁溶液反应Fe + 2Fe3+=3 Fe2+
15.下列有关氧化还原反应的叙述正确的是
A.肯定有一种元素被氧化,另一种元素被还原
B.在反应中不一定所有元素的化合价都发生变化
C.任何一个置换反应一定属于氧化还原反应
D.化合反应和复分解反应不可能有氧化还原反应
16.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关。下列各组物质由于浓度不同而能发生不同氧化还原反应的是
A.铜与硝酸
B.铜与氯化铁溶液
C.锌与硫酸
D.铁与盐酸
17.设NA 代表阿伏加德罗常数,下列说法正确的是
A.18g水中含有的电子数为10NA
B.100 mL 2.0 mol / L 的盐酸与硫酸溶液中氢离子均为0.2NA
C.标准状况下,22.4L氦气与22.4L氟气所含原子数均为2 NA
D.5.6g 铁与足量盐酸反应转移的电子数为0.3NA
18.实验室制Cl2的反应为4Hcl(浓)+MnO2 Mncl2 + Cl2 个+2H2O 。下列说法错误的是
A.还原剂是HCl ,氧化剂是MnO2
B.每生成1 mol Cl2 ,转移电子的物质的量为2mol
C.每消耗1 molMnO2 ,起还原剂作用的HCI 消耗4mol
D.生成的Cl2中,除含有一些水蒸气外,还含有HCI 杂质
19.在含FeCl3 、FeCl2、AlCl3 、NaCl的溶液中,加入足量的Na2O 固体,在空气中充分搅拌反应后再加入过量的稀盐酸,溶液中离子数目变化最小的是
A.Na+ B.Al3+ C.Fe3+ D.Fe2+
Mncl2 + Cl2 个+2H2O 。下列说法错误的是
A.还原剂是HCl ,氧化剂是MnO2
B.每生成1 mol Cl2 ,转移电子的物质的量为2mol
C.每消耗1 molMnO2 ,起还原剂作用的HCI 消耗4mol
D.生成的Cl2中,除含有一些水蒸气外,还含有HCI 杂质
19.在含FeCl3 、FeCl2、AlCl3 、NaCl的溶液中,加入足量的Na2O 固体,在空气中充分搅拌反应后再加入过量的稀盐酸,溶液中离子数目变化最小的是
A.Na+ B.Al3+ C.Fe3+ D.Fe2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com